Neuroinflammation:
Abstract
Gelek rêzikên delîlan rola pathogenîk a neuroinflammasyonê di nexweşiya derûnî de piştgirî dikin. Dema ku nexweşiyên otoîmmune yên pergalî sedemên baş-belgekirî yên nexweşiyên neuropsîkiyatrîkî ne, encefalîtîdên otoîmmune yên synaptîk ên bi nîşanên psîkotîk bi gelemperî têne nas kirin. Paralel bi girêdana di navbera nîşanên derûnî û xweseriyê de di nexweşiyên otoîmmune de, anormaliyên neuroimmunolojîk di nexweşiyên derûnî yên klasîk de çêdibin (mînakî, depresîv, bipolar, şîzofreniya, û nexweşiyên obsessive-mecbûrî). Vekolînên li ser patofîzyolojiya van şertan bi kevneşopî li ser nerêkûpêkkirina pergalên glutamatergîk û monoamînergîk sekinîn, lê mekanîzmayên ku dibin sedema van anormaliyên neurotransmitter nezelal dimînin. Em pêwendiya di navbera xweserî û nexweşiyên neuropsîkiyatrî de, û delîlên mirovî û ezmûnî yên ku piştgirî didin rola pathogenîkî ya neuroinflammasyonê di nexweşiyên derûnî yên klasîk ên bijartî de dinirxînin. Fêmkirina ka pergalên psîkososyal, genetîkî, immunolojîk û neurotransmitter çawa bi hevûdu re têkildar in dikare nîşanên pathogenîk eşkere bike û bibe alîkar ku dermanên nû yên pêşîlêgirtin û semptomatîk bikin armanc.
Keywords:
- Neuroinflammation,
- Psîkoneuroîmmunolojî,
- Astrocyte,
- Microglia,
- Cytokines,
- Stresa oksîdatîf,
- Hişleqî,
- Nexweşiya obsessive-mecbûrî,
- Nexweşiya Bipolar, Şîzofrenî
Contents
Pêşkêş
Her ku anormaliyên biyolojîkî di nav nexweşên bi nexweşiyên derûnî de her ku diçe têne nas kirin, cûdahiya di navbera nexweşiyên neurolojîk û derûnî de winda dibe. Ji bilî nexweşiyên otoîmmune yên pergalî yên ku bi diyardeyên derûnî ve girêdayî ne (mînak, lupus) [1], di van demên dawî de, nexweşên bi psîkoza veqetandî ya akût bi encefalîtîdên otoîmmune synaptîk ve hatin nas kirin (Table 1) [2-6]. Van nexweşan bi gelemperî bi xeletî bi nexweşiyên psîkotîkî yên seretayî yên refraktîkî têne teşhîs kirin, ku destpêkirina terapiya berevaniya bi bandor dereng dixe (Table 1). Wekî din, delîlên mezin piştgirî didin rola pathogenîkî ya antî-neuronal di nexweşiyên neuropsychiatrî de [7].
Veqetandina nexweşiyên neurolojîk û derûnî, ku bi têgihîştina Descartes a "hiş" wekî hebûnek ji hêla ontolojîkî ve cihêreng ve hatî piştgirî kirin û bi veberhevbûna anormaliyên neuropatolojîk ve, li derman serdest bû.sedsala 19-an û destpêka sedsala 20-an [8]. Ji hingê ve, berhevokek berfireh a sedemên biyolojîkî yên ji nû ve hilberandin, ji neurosyphilis, travmaya serê, stok, tumor, demyelination û gelekên din bûn sedema kompleksên nîşanan ên ku bi nexweşiyên derûnî yên klasîk re hevgirtî bûn [9-11]. Di van demên dawî de, anormaliyên neuroînflamatuar û immunolojîk di nexweşên bi nexweşiyên derûnî yên klasîk de hatine belge kirin.
Modulatorên berevaniya periferîkî dikarin di modelên heywanan û mirovan de nîşanên derûnî derxînin [12-19]. Heywanên saxlem bi IL-1 pro-înflamatuar tê derzî kirin? û sîtokînên faktora nekroza tumor a alpha (TNF-?) "tevgera nexweşiyê" ya ku bi vekişîna civakî ve girêdayî ye nîşan dide [12]. Di mirovan de, derzîlêdanên endotoksîna kêm-doz striatuma zikê, herêmek ku ji bo hilberandina xelatê krîtîk e, bêbandor dike, anhedonia nîşanek depresyonê ya bêhêz çêdike [14]. Nêzîkî 45% ji hepatît C û nexweşên penceşêrê yên ku bi IFN-? nîşanên depresyonê bi zêdebûna asta IL-6 ya serumê re têkildar in [12,15,17,18].
Rewşên bijîjkî yên ku bi anormaliyên înflamatuar û immunolojîk ên kronîk ve girêdayî ne, di nav de qelewbûn, şekir, nexweşiyên xirab, arthritis romatoid, û skleroza piralî, faktorên xetereyê ne ji bo depresyonê û tevliheviya bipolar [10,12,13,15,17,18]. Ya erênîpêwendiya di navbera van şert û mercên bijîjkî û nexweşiya derûnî de hebûna pêvajoyek înflamatuar a bingehîn a berbelav ku li mêjî di nav organên din de bandor dike [10,19,20] pêşniyar dike. Lêkolînek 30-salî ya li ser nifûsê destnîşan kir ku hebûna an nexweşiya otomîmûnê an jî rakirina nexweşxaneyê ya berê ji bo enfeksiyonek cidî xetera pêşkeftina şîzofreniyê bi rêzê 29% û 60% zêde kir [16]. Wekî din, virusê herpes simplex, Toxoplasma gondii, cytomegalovirus, û grîpê di dema ducaniyê de xetera pêşkeftina şîzofreniyê zêde dike [16].
Nexweşiyên hucreyên periferîkî [21,22] (Table 2), û anormaliyên immunolojîkî yên humoral [13,21-23] di nexweşên derûnî de li gorî kontrolên saxlem pirtir in. Hem di pîlot (n = 34 nexweşên bi nexweşiya depresyonê ya mezin (MDD), n = 43 kontrolên saxlem) û hem jî di lêkolînên dubarekirinê de (n = 36 MDD, n = 43 kontrolên saxlem), ceribandinek serûmê ku ji neh biyomarkerên serumê pêk tê, mijarên MDD ji saxlem cuda dike. bi 91.7% hestiyar û 81.3% taybetmendiyê kontrol dike; Molekulên immunolojîk alpha 1 antîtrîpsîn, myeloperoxidase, û TNF-ya çareserker bi girîngî biyomarkerên ji bo nîşanên neuropsîkiyatrîkî bilind bûn? receptor II [23].
 Em pêşî pêwendiya di navbera xweserî û nexweşiyên neuropsîkiyatrîk de dinirxînin, di nav de: 1) lupus erythematosus pergalî (SLE) wekî prototîpek nexweşiya xweseriya pergalî; 2) encefalîtîdên otoîmmune yên ku bi otoantîboksên antî-synaptîk û glutamic acid decarboxylase (GAD) ve girêdayî ne; û 3) Nexweşiyên xweseriya neuropsîkiyatrîkî yên zarokan ên bi enfeksiyonên streptokok (PANDAS) û tevliheviya obsessive-mecbûrî ya paqij (OCD) ve girêdayî bi ganglia antî-bazal / otoantîbodîtên talamîk re têkildar in. Dûv re em rola iltîhaba/xweseriya xwerû di nexweşiyên derûnî yên klasîk de, di nav de MDD, nexweşiya bipolar (BPD), şîzofreniya, û OCD-ê de nîqaş dikin.
Em pêşî pêwendiya di navbera xweserî û nexweşiyên neuropsîkiyatrîk de dinirxînin, di nav de: 1) lupus erythematosus pergalî (SLE) wekî prototîpek nexweşiya xweseriya pergalî; 2) encefalîtîdên otoîmmune yên ku bi otoantîboksên antî-synaptîk û glutamic acid decarboxylase (GAD) ve girêdayî ne; û 3) Nexweşiyên xweseriya neuropsîkiyatrîkî yên zarokan ên bi enfeksiyonên streptokok (PANDAS) û tevliheviya obsessive-mecbûrî ya paqij (OCD) ve girêdayî bi ganglia antî-bazal / otoantîbodîtên talamîk re têkildar in. Dûv re em rola iltîhaba/xweseriya xwerû di nexweşiyên derûnî yên klasîk de, di nav de MDD, nexweşiya bipolar (BPD), şîzofreniya, û OCD-ê de nîqaş dikin.
Nexweşiyên Neuropsîkiyatrîkî yên Bi Xweseriya Xweserî ve girêdayî ne
Sîstematîk Lupus Erythematosus
Di navbera 25% û 75% nexweşên SLE de tevlêbûna pergala nerva navendî (CNS) heye, ku nîşanên derûnî bi gelemperî di nav du salên pêşîn ên destpêkirina nexweşiyê de çêdibin. Nîşaneyên psîkiyatrîkî dibe ku fikar, mood û tevliheviyên psîkotîk [97] hene. Wêneya rezonansê ya magnetîkî ya mêjî (MRI) bi qasî 42% ji bûyerên SLE yên neuropsîkiyatrîkî normal e [97]. Mîkroangiopatî û têkçûna astenga mêjî ya xwînê (BBB) dibe ku destûrê bide ketina otoantîbodîyan nav mejî [97]. Van antîbotan P antî-rîbozomal (di 90% ji nexweşên SLE yên psîkotîk de erênî ye) [1], şaneya antî-endotelîal, antî-gangliosîd, antî-dsDNA, binbeşên antî-2A/2B yên receptorên N-methyl-D-aspartate hene. NMDAR) û antî-fosfolîpîd [97]. Sîtokînên pro-înflamatuar-bi bingehîn IL-6 [97], S100B-[97], molekula adhezyonê ya hundurîn 1 [97] û matrix- metalloproteinase-9 [98] jî di SLE de bilind dibin. Nîşaneyên derûnî yên SLE, nexweşiya Sjo?gren, sendroma Susac, vaskulît CNS, nexweşiya CNS Whipple, û nexweşiya Behc?et di van demên dawî de hatine lêkolîn kirin [1].
Encephalitîdên Xweserî yên Neuropsîkîatrîk ên Bi Serum Antî-Synaptîk & Acida Glutamic Decarboxylase ve girêdayî ne
Autoantibodies
Encefalîtîdên otoîmmune bi destpêkek tûj a girtina lobeya demkî, taybetmendiyên derûnî, û kêmasiyên cognitive [2,3,99-108] têne diyar kirin. Patofîzyolojî bi gelemperî ji hêla otoantîbodîkên ku otoantîjenên synaptîk an hundurîn-hucreyî re têkildar in bi eslê xwe paraneo plastîk an neparaneoplastîk re dikin armanc [3]. Otoantîbozên dijî-synaptîk jêrbeşên NR1 yên NMDAR [100,108,109], kompleksên kanala potasyumê (VGKC) yên bi voltajê (VGKC) (binyekîneya Kv1, glioma bi leucîn-ê dewlemend neçalakkirî (LGI1) û proteîna têkildar a têkiliyê 2 (CASPRlu2, 101,102,106 (CASPRlu 1, 2, 3, 5, 4, 6,110,111, 1)) dikin hedef. Binbeşên GluR3,99,103 yên receptorên amino-65-hîdroksî-2,3-methyl-l-XNUMX-isoxazolepropionic asîdê (AMPAR) [XNUMX] û BXNUMX-yên receptorên ?-aminobutyric acid B (GABABR) [XNUMX]. Otoantîpoşên dijî-hucreyî yên onconeuronal û otoantîjenên GAD-XNUMX armanc dikin [XNUMX].
Iltîhaba ku bi otoantîbodîtên dijî-synaptîk ve, nemaze otoantîbodên NMDAR-ê ve girêdayî ye, bi gelemperî ji ya ku bi GAD-otoantîbodîs an oto-antîbodên antî-neuronî ve girêdayî bi nexweşiyên xweser ên pergalê an sendromên paraneoplastîk ve girêdayî ye pir nermtir e [2,107].
Her çend nîşanên neurolojîkî di dawiyê de derdikevin jî, diyardeyên psîkiyatrîkî, ji tirsê [2,3] heya psîkoziya ku şîzofreniya teqlîd dike [2-6], di destpêkê de dikarin li ser taybetmendiyên neurolojîkî serdest bibin an pêşî li wan bigirin. Zêdeyî du-sêyan nexweşên bi encefalîta otoîmmune ya dijî-NMDAR, di destpêkê de pêşkêşî karûbarên derûnî dibin [5]. Pêdivî ye ku encephalîtîdên otoîmmunî yên bi navbeynkariya antî-sînaptîk di cihêrengiya psîkoza akût de bêne hesibandin [2-6]. Pêşniyarên psîkolojîk dikarin MRI-ya mêjî ya normal û analîza şilava cerebrospinal (CSF), bêyî encefalopatî an destgirtinê pêk bînin [2,3,5,6,107]. Me dozek otoantîbodên GAD-ê yên seropozîtîv ên ku bi neuroînflamatuara biopsiyê ve girêdayî ye, tevî analîzên MRI û CSF-ya normal ên mêjî, ku nexweş bi psîkoza veqetandî ya ku ji hêla Destûra Teşhîs û Statîstîk a Nexweşiyên Derûnî ve hatî teşhîs kirin, pêşkêşî kir. [4]. Zêdetir, encefalîtîdên otoîmmune yên seronegatîv jî dikarin bi tevliheviyên neuropsîkiyatrîkî yên berbiçav re diyar bibin, ku teşhîs bêtir zelal dike [2]. Taybetmendiyên derûnî û neurolojîk ên ku bi xweseriya antî-sînaptîk û GAD-ê ve girêdayî ne di Tablo 107,112,113 de têne kurt kirin [1-1-6,99].
Di nexweşên bi nexweşiyên psîkatrîkî yên safî [2,4,5,112,115-121] de, otoantîbodîtên antî-synaptîk û GAD yên serumê dikarin çêbibin. Di hevokek paşerojê ya 29 mijaran de ku pîvanên DSM-IV ji bo şîzofreniyê bicîh anîn, di sê mijaran de otoantîbozên antî-NMDAR yên serumê, û di mijarekê de otoantîboksên antî-VGKC-kompleks hatin dîtin [5]. Di 1 nexweşên bi şîzofreniya diyarkirî de, bi karanîna teknîkên hesastir ji bo tespîtkirina oto-antîpotên immunoglobulin G (IgG) G (IgG) NR100, ti otoantîbodî nehatin nas kirin [122]. Lêbelê, vê lêkolînê otoantîpên ku li jêr yekîneya NR2 ya NMDAR-ê armanc dikin, nenirxand. Lêkolînên din ragihandin ku di nav kesên bi mania akût de şansê bilindbûna (? 90-an asta kontrolê ya ne-psîkiyatrîkî) bi girîngî zêde kirine (rêjeya şansê (OR) 2, 2.78% navbera pêbaweriyê (CI) 95 heta 1.26, P = 6.14). n = 0.012), lê ne di mania an şîzofreniya kronîk de [43].
PANDAS & Nexweşiya Obsessive-Mecburî ya Paqij ku Bi Ganglia Dij-Basal / Otoantîbodîtên Thalamic re têkildar e
OCD bi gelemperî nexweşiyên neurolojîkî yên ku gangliayên bingehîn tevlî koreya Sydenham, nexweşiya Huntington û nexweşiya Parkinson vedihewîne tevlihev dike. Di koreya Sydenham [123] de antîkorên ganglia yên dijî-bazal têne têkildar kirin. PANDAS bi enfeksiyonek streptokok a ?-hemolîtîk a koma A prodromal bi zêdebûna akût nîşanên OCD û/an tîkên motor/fonîk ve tê diyar kirin. Tê texmîn kirin ku pathofîzyolojî di navbera antî-streptokok û proteînên ganglia yên bingehîn de reaktîfiya xaçê vedigire [124]. Têkiliya klînîkî ya di navbera PANDAS û OCD-a paqij de mekanîzmayek etiolojîkî ya hevpar pêşniyar dike [125].
Di nav komeke rasthatî ya 21 nexweşên OCD-ê yên paqij de, 91.3% xwedî gangliayên dijî-bazal ên CSF (P <0.05) û otoantîboyên antî-talamîk (P <0.005) di 43 kDa de [88], anormaliyên fonksiyonel ên di cortico-striatal-striatal de hevaheng in. -Şirxa kortikê ya mijarên OCD [84]. Lêkolînek din belge kir ku 42% (n = 21) ji mijarên zarokan û ciwanan ên OCD xwedî otoantîbozên ganglia yên dijî-bazal ên serumê li 40, 45, û 60 kDa li gorî 2% û 10% ji kontrolan (P = 0.001) [7]. Di sermaya 64% ji mijarên PANDAS (n = 14) de otoantîbozên antî-basal ganglia hatin tesbît kirin, li gorî tenê 9% (n = 2) yên kontrolên streptokok-erênî/OCD-neyînî (P <0.001) [126]. Lêkolînek di navbera belavbûna xweseriya ganglia-bingehîn de di OCD (5.4%, n = 4) de li hember kontrolên MDD (0%) de ti cûdahî nedît [127]; lêbelê, sînorkirinek karanîna rasthatî ya kortikê mêş û ganglia û kortikên bingehîn ên gayan bû ku dibe ku nasnameya bûyerên seropozîtîv sînordar bike.
Otoantîjenên ganglia yên bingehîn aldolase C (40 kDa), enolaza neuronal-taybet/ne-neuronî (45 kDa dubendî) û pîrûvate kînaza M1 (60 kDa)-enzîmên glîkolîtîk ên neuronal in- ku di neurotransmission, metabolîzma neuronal de cih digirin.
Rûpel 3 ji 24 û sînyala şaneyê [128]. Van enzîman bi proteînên streptokokî re hevolojiya avahîsaziyek girîng nîşan didin [129]. Lêkolîna herî dawî (96 OCD, 33 MDD, 17 mijarên şîzofreniyê) sermaya nexweşan li dijî pyruvate kinase, aldolase C û enolase ceribandin, bi taybetî; rêjeyek zêde ya mijarên OCD-ê li gorî kontrolê sero-erênî bûn (19.8% (n = 19) beramberî 4% [n = 2], P = 0.012) [130].
Lêbelê, di heman lêkolînê de tenê yek ji 19 mijarên OCD-ê yên sero-erênî di heman demê de tîrên antî-streptolîsîn O-ya erênî jî hebûn, ku pêşniyar dike ku di OCD-ya safî de seronegatîvîteya antî-streptolysîn O hebûna otoantîbodên ganglia yên dijî-bazal dernakeve. .
Di OCD-a safî de, sero-erênîbûna ji bo ganglia antî-bazal / antîkorên talamîk bi zêdebûna astên glycine CSF (P = 0.03) [88] ve girêdayî ye, û destnîşan dike ku van antî-laşan beşdarî hyperglutamatergia-ya ku di OCD de tê dîtin [84,88,131]. Başkirina OCD-a enfeksiyonê ya bi tedawiyên bêparastin re piştgirî dide pathogenîkbûna van otoantîbodîyan [132]. Dadgehek mezin a NIH-ê ku bandorkirina immunoglobulin intravenous (IVIG) ji bo zarokên bi destpêka OCD û antî-streptokok a tûj û antî-streptokok re dinirxîne berdewam e (ClinicalTrials.gov: NCT01281969). Lêbelê, dîtina astên glutamate CSF hinekî bilindtir di nexweşên OCD de bi ganglia antî-bazal / antî-laşên talamîk ên neyînî yên CSF-ê re li gorî yên ku bi antîbozên CSF-ê erênî ne diyar dike ku mekanîzmayên ne-immunolojîk dikarin di OCD de rola xwe bilîzin [84]. Mekanîzmayên din, tevî iltîhaba bi navbeynkariya cytokine (Table 2), di heman demê de hîpotez in.
Nexweşiyên derûnî yên ku bi iltîhaba xwerû ve girêdayî ne
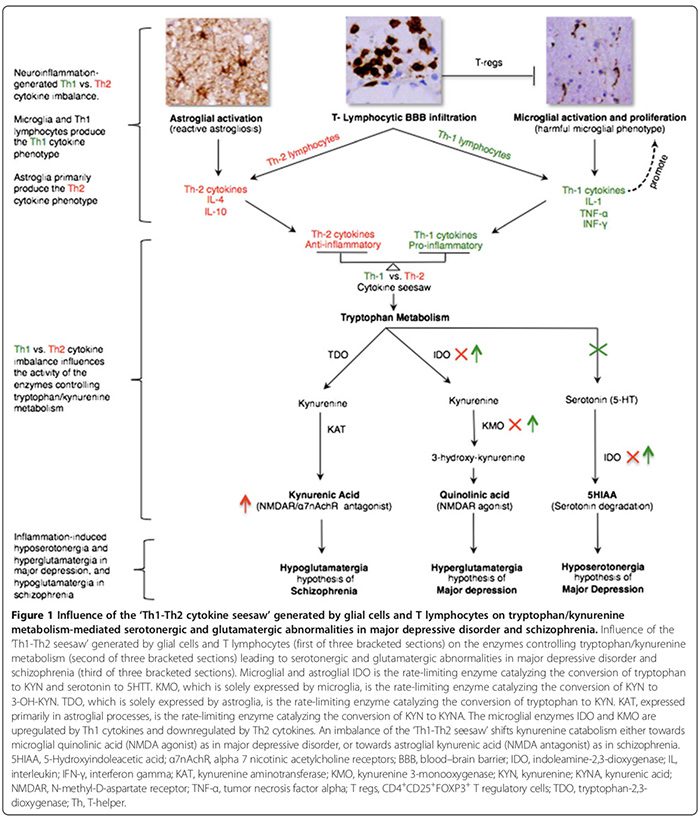
Di hin nexweşên bi nexweşiyên derûnî yên klasîk de nexweşiyên iltîhaba/xweserûberiya xwedayî çêdibin. Em anormaliyên CNS-ê yên zikmakî yên ku bi iltîhaba ve girêdayî ne- di nav de patholojiya glial, asta bilindbûna cytokines, çalakkirina cyclo-oxygenase, nerêkûpêkkirina glutamate, zêdebûna asta S100B, zêdebûna stresa oksîdative, û xerabûna BBB-di MDD, BPD, şîzofreniya, û OCD de nîqaş dikin. Em her weha diyar dikin ka meriv çawa iltîhaba xwerû dibe ku bi mekanîzmakî bi nenormaliyên monoaminergîk û glutamatergîk ên kevneşopî yên ku di van nexweşiyan de hatine ragihandin ve were girêdan (Wêne 1 û 2). Di nexweşiyên derûnî de rola dermankirinê ya dermanên antî-înflamatuar jî tê nirxandin.
 Histopatholojiya Astroglial & Oligodendroglial
Histopatholojiya Astroglial & Oligodendroglial
Astroglia û oligodendroglia ji bo neuralî bingehîn in maddeyan homeostasis, tevger û fonksiyonên cognitive bilind [54-56,133-136]. Astroglia bêdeng a normal enerjî û piştgirîya trofî dide neuronan, veguheztina neurotransformasyona synaptîk (Wêne 2), synaptogenesis, herikîna xwîna mêjî, û yekbûna BBB-ê diparêze [134,136,137]. Olîgodendroglia gihîştî enerjî û piştgirîya trofîkî dide neuronan û yekitiya BBB diparêze, û tamîrkirina aksonal sererast dike.û myelination rêyên maddeya spî peydakirina pêwendiya nav- û hundurîn-hemspherîk [54-56]. Hem astroglia û hem jî oligodendroglia sîtokînên dijî-înflamatuar hilberînin ku dikarin iltîhaba zirardar kêm bikin [52,55].
Di MDD-ê de, windabûna astroglial di nav deverên têkildar ên fonksiyonel de, di nav de kortika singulate ya pêşiyê, kortika pêşîn, amygdala, û maddeya spî [35-38,42-46,55,138-147], bi çend îstîsnayan vedîtinek piştî mirinê domdar e [42,43 ,37,38]. Lêkolînên piştî mirinê kêmbûna proteîna astroglial a fîbrîlar a glial (GFAP)-erênî di serî de di kortika pêşgotinê de [36] û amygdala [39] kêm kir. Analîzek mezin a proteomîkî ya kortikên pêşiyê yên ji nexweşên depresiyonî kêmbûnek girîng di sê isoformên GFAP de nîşan da [75]. Her çend di lêkolînek de ku windahiyek girîng a glial tune ragihand, analîza binekomê di nav mijarên lêkolînê de ji 45 salî piçûktir de kêmbûnek girîng (35%) di dendika astroglial ya GFAP-erênî de eşkere kir [148]. Lêkolînek morfometrîkî bi heman rengî di mejiyên MDD yên dereng de guheztinek di dendika glial de tune [35]. Em hîpotez dikin ku nebûna eşkere ya windabûna astroglial di nav nexweşên pîr ên MDD de dibe ku astroglioza duyemîn [42,50] ku bi temenek mezin re têkildar e [XNUMX] ji negatîfek rastîn nîşan bide.
Lêkolînên heywanan bi lêkolînên mirovan re hevaheng in ku windabûna astroglial di MDD de nîşan didin. Mişkên Wistar-Kyoto-yê ku tê zanîn tevgerên depresîv-depresyonî nîşan didin di heman deveran de ku di mirovan de têne dîtin de tîrêjiya astroglial kêm kir [40]. Birêvebirina astroglial-toksîk, L-alpha-aminoadipic acid, nîşanên mîna depresyonê di mişkan de çêdike, û destnîşan dike ku windabûna astroglial di MDD de pathogenîk e [41].
Lêkolînên paş-mirinê yên mijarên MDD-ê di korteksa pêşîn û amygdala de kêmbûna oligodendroglial kêm kir [54-57,66], ku dibe ku bi guhertinên maddeya spî ya navendî ya MRI-ya mêjî re têkildar be ku carinan di hin nexweşên MDD de têne destnîşan kirin [57]. Lêbelê, anormaliyên mîkrovaskuler jî dibe ku beşdarî van guhertinan bibin [57].
Di BPD de, hin lêkolîn windabûna girîng a glial nîşan didin [138,143,149,150], lê yên din na [37,44-46]. Dibe ku ev vedîtinên nakokî ji nebûna kontrolê derkevin: 1) dermankirina bi stabîlkerên moodê, ji ber ku analîza post-hoc ya ku ji hêla hin lêkolînan ve hatî ragihandin kêmbûna girîng a windabûna glial tenê piştî kontrolkirina dermankirina bi lîtium û asîda valproîk [46] nîşan dide; 2) formên malbatî yên BPD, ji ber ku windabûna glial bi taybetî di nav nexweşên BPD yên xwedî dîrokek malbatî ya bihêz de diyar e [143]; û / an, 3) rewşa serdest a depresyonê li hember mania, ji ber ku windabûna glial di MDD de pir caran e [35-38,42-46,55,138-147]. Ma astroglia an oligodendroglia piraniya windabûna glial ne diyar e; dema ku analîza proteomîk di yek îsoforma GFAP astroglial de kêmbûnek girîng eşkere kir [39], çend lêkolînên din ên piştî mirina neguhêrbar dîtin [36,37] an jî îfadeya astroglial-erênî ya GFAP-ê di kortika orbitrofrontal de [47] kêm kirin, an jî dendika oligodendroglial kêm kirin [54] 56,58,59-XNUMX].
Di şîzofreniyê de, windabûna astroglial vedîtinek nehevgirtî ye [48,150]. Digel ku hin lêkolînan windabûna astroglial ya girîng nîşan nedan [42,50,51], çend kesên din di du isoformên GFAP de kêmbûna dendika astroglial [37,38,43,44,48,49,151] kêm kirin [39]. Encamên nelihev dibe ku ji: 1) Nexweşiya MDD, ku pir caran bi windabûna glial ve girêdayî ye; 2) Guhertina temen, ji ber ku nexweşên pîr astroglia GFAP-erênî zêde kirine [35,42,50]; 3) guherbariya qata herêmî [150] û kortikal [48]; 4) dermankirina bi dermanên antîpsîkotîk, ji ber ku lêkolînên ezmûnî nîşan didin ku hem kêm [152] hem jî zêde [153] astroglial-density bi dermankirina antîpsîkotîkî ya kronîk ve girêdayî ye [70]; û 5) rewşa nexweşiyê (mînak, xwekujî li hember tevgera nexwekujî) [154]. Lêkolînên post-mortem windabûna oligodendroglial [54,56,60-65,148,155,156], bi taybetî di korteksa pêşîn, korteksa cingulate ya pêşîn, û hîpokampus [148] de belge kirin. Muayeneya Ultrastructural ya herêma prefrontal hem di maddeya gewr û hem jî di spî de fîberên ne normal ên myelinated nîşan da; hem temen û hem jî dirêjahiya nexweşiyê bi anormaliyên maddeya spî re têkildar bûn [157].
Berevajî nexweşiyên neurodejenerative ku bi gelemperî bi belavbûna astroglial re têkildar in [136], nexweşiyên derûnî li şûna wan bi dendika astroglial ya kêmkirî an neguhêrbar ve girêdayî ne [138]. Kêmbûna zêdebûnek glial di nexweşiyên psîkiyatrîkî yên destpêkê de [44,138] dibe ku rêjeya hêdîtir a pêşkeftina dejenerasyonê di nexweşiyên derûnî de nîşan bide [138].
Em destnîşan dikin ku guheztinên dejenerasyonê yên ku bi nexweşiyên derûnî ve girêdayî ne naziktir in û ne ew qas giran in ku faktorên veguheztina hundurîn ên astroglial ên ku astrogliosis bi erênî rêve dikin, di nav de aktîvatorê veguhezerê nîşana transkripsiyonê 3 û faktora nukleerê kappa B (NF-?B) [136].
Dema ku piraniya lêkolînên piştî mirinê balê dikişînin ser guheztina dendika glial di MDD, BPD, û şîzofreniyê de, yên din guhertina morfolojiya hucreya glial, bi vedîtinên tevlihev vedibêjin. Di MDD û BPD de, mezinahiya glial an zêde ye an nayê guhertin [55]. Lêkolînek di BPD û şîzofreniyê de mezinahiya glial kêm kir lê ne di MDD de [43]. Lêkolînek piştî mirinê ya li ser nexweşên depresyonî yên ku xwekujî kirine dît ku mezinahiya astroglial di maddeya spî ya pêşiyê de lê ne di korteksê de zêde bûye [158]. Lêkolînek di mijarên şîzofrenîkî de dît ku mezinahiya astroglial di qata V ya korteksa pêşgotinê ya dorsolateral de bi rengek berbiçav kêm bûye, tevî ku dendika astroglial du qat ji ya kontrolên di heman qatê de ye [48]. Encamên tevlihev dibe ku bi qismî lêkolînên berê yên guherînên glial ên di nexweşiyên derûnî de ku astroglia li hember oligodendroglia diyar nekirine nîşan bide [148].
Di nexweşiyên derûnî de windabûna glial dikare bi gelek mekanîzmayan ve bibe sedema înflamasyona nervê, di nav de astên cytokine yên ne normal (li beşa Cytokine binêre), metabolîzma glutamate ya nerêkûpêk (li beşa Glutamate binêre), proteîna S100B ya bilind (li beşa S100B binêre),û fonksiyona BBB-ê guhert (binihêrin beşa astengiya mêjî ya xwînê), ku di encamê de têgihîştin û tevgerê xera dibe [44,45,54,133,159].
Histopatholojiya Mîkroglial
Microglia hucreyên parastinê yên niştecîh ên CNS ne. Ew çavdêriya berevaniyê ya domdar peyda dikin û qutkirina synaptîk a pêşkeftinê birêkûpêk dikin [160,161]. Birîna CNS-ê mîkroglia bêhnvedanê ya birêkûpêk vediguhezîne şaneyên amoeboîd ên fagosîtîk ên mîna rod-ê dirêjkirî û mîna makrofage-yê yên aktîfkirî yên ku ber bi cîhê zirarê ve li ber gradientên kemotaktîk (ango, aktîvkirin û belavbûna mîkro-glial (MAP)) zêde dibin û koç dikin [161]. Hucreyên mîkroglial ên mirovî NMDAR-ên ku dibe ku navbeynkariya MAP-ê bike ku bibe sedema zirara neuronal diyar dikin [162].
Di MDD, BPD û şîzofreniyê de, encamên lêkolînên piştî mirinê yên ku hebûna MAP-ê lêkolîn dikin tevlihev in. Lêkolînên piştî mirinê tenê di yek ji pênc mijarên MDD-ê de MAP-ê bilind kirin [67]. Di hin nexweşên nexweşiya BPD de, zêdebûna mîkroglia antîjen-DR-erênî ya leukocîtê ya mirovî ku pêvajoyên qalind nîşan dide di korteksa pêşiyê de hate belge kirin [69]. Di şîzofreniyê de, dema ku hin lêkolînan MAP-ê li gorî kontrolê bilind kirin, yên din di navbera koman de cûdahî nîşan nedan [22,67,70]. Di lêkolînek piştî mirinê de ku MAP-ê di MDD û BPD de dinirxîne; Tîrêjiya hucreya mîkroglial-acîdê quinolinic-pozîtîf di kortika singulate ya bine-genual û korteksa navîn a pêşiyê ya nexweşên MDD û BPD yên ku li gorî kontrolê xwekujî kirine zêde bû [53]. Analîza post-hoc eşkere kir ku ev MAP-a zêde tenê ji MDD-ê ve girêdayî ye û ne ji BPD-ê re, ji ber ku di mijarên MDD-ê de immuno-rengdêriya mîkroglial ya erênî bi girîngî ji ya di binkoma BPD-ê de hem di kortikên singulate pêşiyê yên jêrîn û hem jî di kortikên navîn de mezintir bû, û ji ber ku dendika mîkroglia hem di BPD hem jî di komên kontrolê de [53] wekhev bû. Lêkolînek ku her sê nexweşiyan berhev dike (neh MDD, pênc BPD, çardeh şîzofreniya, deh kontrolên saxlem) di çar koman de cûdahiyek girîng di dendika mîkroglial de tune [68].
Van encamên tevlihev dibe ku ji nîşangirên immunolojîk ên mîkroglial ên guhezbar ên ku di nav lêkolînên cihêreng de têne bikar anîn [70] û / an têkçûna kontrolkirina giraniya nexweşiyê [22,53,68] ve têne veqetandin. Nemaze, sê lêkolînên piştî mirinê yên MDD û mijarên şîzofrenîkî pêwendiyek erênî ya bihêz di navbera MAP û xwekuştinê de di kortika singulate ya pêşîn û talamusa navîn de, bêyî teşhîsa derûnî [22,53,68] belge kirin. Ji ber vê yekê, MAP ji bo MDD û şîzofreniyê ji bilî nîşanek taybetmendiyê dibe dewletek.
Di OCD-ê de, modelên heywanan pêşniyar dikin ku bêfonkasyon û kêmkirina hin fenotîpên mîkroglial, wekî yên ku gena Hoxb8, ku faktora veguheztina homeobox-ê kod dike, vedibêjin, dikare bibe sedema tevgerên mîna OCD [71,72].
Mişkên Hoxb8 yên nockout bi tevlêbûna kêmbûna tîrêjiya mîkroglial re tevger û fikarek zêde nîşan didin [71,72]. Ev behremendiya zedeyî dişibihe taybetmendiyên behrê yên OCD-a mirovî. Derzîlêdana Hoxb8 di mêşên gûzên Hoxb8 yên mezin de windabûna mîkroglial berevajî dike û tevgera normal vedigerîne [71,72]. Rola van fenotîpên mîkroglial ên taybetî di OCD-a mirovî de ne diyar e.
Daneyên ezmûnî destnîşan dikin ku MAP fenotîpên zerardar û neuroprotektîf ên diyar pêk tîne (Wêne 2). Mîkrogliayên zerardar kompleksa hîstokompatîbilîteya mezin II (MHC-II) îfade nakin û, ji ber vê yekê, nekarin wekî şaneyên pêşkêşkerê antîgen (APC) tevbigerin [163,164]; ew bi hilberîna cytokine pro-înflamatuar, nîşankirina sentaza nîtrîk oksîtê [17,69,165], bandorên zirardar [17,166] pêşve dixin, îfadeya glial û BBB-pericyte/endothelial cyclooxygenase- 2 (COX-2) [167] (SB100e100B17,136,168,169 sirrê SB2) vedigire beş), û serbestberdana glutamate ya mîkroglial [2]. Di heman demê de mîkroglia zirardar jî prostaglandin E-2 (PGE-29) vedişêre ku hilberîna sîtokînên proînflamatuar pêşve dike, ku di encamê de asta PGE-2 di çerxa pêş-rojê de zêde dike [2]. Zêdetir, PGE-2 îfadeya COX-29 teşwîq dike, ku navbeynkariya veguheztina asîdê arachidonic bo PGE-XNUMX dike, çerxek din a pêş-rojanê saz dike [XNUMX].
Berevajî vê, mîkroglia neuroprotektîf dikare: 1) MHC-II in vivo û in vitro [163,166] îfade bike û wekî APC-ya hevnas tevbigere (Wêne 2) [163,164,166]; 2) bi pêşvebirina deranîna sîtokînên antî-înflamatuar [17], faktora neurotrofîk a ji mêjî [17], û faktora mezinbûnê ya mîna însulînê-1 [166], saxbûnê hêsantir dike û birîna neuronal sînordar dike; û 3) veguhezkar-2-a amino asîdê acizker eşkere dike (EAAT2) ku glutamata derveyî hucreyî ya zêde [163,166] ji holê radike, û xweseriya T lîmfosîtîkî ya neuroprotektîf pêşve dike (Wêne 2) [163,164]. Lêbelê, bêtir lêkolîn hewce ne ku ji bo piştrastkirina rola beşdarker a mîkroglia neuroprotektîf di nexweşiyên neuropsîkiyatrî de di mirovan de.
Li vitro lêkolînên heywanan destnîşan dikin ku rêjeya mîkroglia zirardar li hember neuroprotektîf dikare ji hêla bandora torê ya mekanîzmayên dijî-rêkûpêk ên înflamatuar ve were bandor kirin [15,74,164,166]. Van mekanîzmayan hejmara hucreyên birêkûpêk ên CD4 + CD25 + FOXP3 + T neuroprotektîf ((T regs) Wêne 1) [15,74,164,166] û astên sîtokina mêjî; kêm IFN-? astên dikarin mîkroglia neuroprotektîf pêşve bibin (Wêne 2) [166], lê astên bilind dikarin fenotîpa zirardar pêşve bibin [166].
Rola Cytokines
Sîtokînên proînflamatuar IL-1?, IL-2, IL-6, TNF-? û IFN-?. Ew di serî de ji hêla mîkro-glia, Th1 lymphocytes û M1 phenotip monocytes/macrophages ve têne derxistin (Wêne 1) [15,170]. Ew iltîhaba zerardar pêşve dixin. Sîtokînên dijî-înflamatuar IL-4, IL-5 û IL-10 hene. Ew di serî de ji hêla astroglia ve têne veşartinTh2 lymphocytes, T regs û M2 phenotip monocytes/macrophages [15,52,74]. Ew dikarin iltîhaba zerardar [15,74] bi veguheztina M1-feno-tîpa pêş-înflamatuar li M2-fenotîpa antî-înflamatuar a bikêr [15] veguhezînin, û bi potansiyel bi pêşvebirina fenotîpa mîkroglial ya neuroprotektîf [15,17,74,163,166] veguhezînin. Rola sîtokînên proînflamatuar/dij-înflamatuar di nexweşiyên derûnî de ji hêla gelek rêzikên delîlan ve tê piştgirî kirin (Wêne 1, Tablo 2) [15,17,29,52,74].
Di MDD-ê de, meta-analîza herî dawî (29 lêkolîn, 822 MDD, 726 kontrolên saxlem) yên cytokines ên proînflamatuar ên serumê piştrast kir ku receptorê IL-2, IL-6 û TNF-? ast di MDD (nîşankerên taybetmendiyê) de zêde dibin [91], di heman demê de, IL-1?, IL-2, IL-4, IL-8 û IL-10, ji hêla îstatîstîkî ve ji kontrolan cuda ne [91]. Di lêkolînek cytokine ya bingehîn de ku komên MDD (47 xwekuj-MDD, 17 MDD ne-xwekuj, 16 kontrolên tenduristiyê), hem sera IL-6 û hem jî TNF-? bi girîngî bilindtir bûn, dema ku astên IL-2 di mijarên MDD yên ku xwekujî li gorî her du komên din pêk anîn de pir kêmtir bûn [96]. Ev vedîtin pêşniyar dike ku IL-6 û TNF-? nîşankerên dewletê yên MDD jî ne [96]. Kêmbûna asta IL-2 ya serumê ya ku bi tevgera xwekujî ya akût ve girêdayî ye dibe ku girêdana zêde ya bi receptorê wê yê birêkûpêkkirî yê di mêjî de nîşan bide; paralel bi meta-analîza jorîn re ku di MDD-ê de receptorê IL-2-ê çareserker zêde dike [91]. Lêkolînên ku li ser girîngiya klînîkî ya cytokines di MDD de lêkolîn dikin destnîşan kirin ku asta cytokine ya serumê di dema serpêhatiyên depresîv ên akût [171,172] de bilind dibin û piştî dermankirina serketî, lê ne têkçûyî, bi antîdepresantan [17] û terapiya elektro-konvulsîv [29] têne normalîze kirin; Van dîtinan ji bo cytokines rolek pathogenîk a muhtemel pêşniyar dikin.
Di BPD de, guhertinên cytokine yên serumê di vekolînek vê dawiyê de hatine kurt kirin; TNF-?, IL-6 û IL-8 di qonaxên manîk û depresîf de bilind dibin, lê di dema mania de IL-2, IL-4 û IL-6 bilind dibin [92]. Lêkolînên din destnîşan kirin ku sera IL-1? û astên receptorên IL-1 ji hêla îstatîstîkî ve ji kontrolên saxlem cuda ne [92], her çend lêkolînên tevnvîsê astên zêde yên IL-1 belge kirin? û receptorê IL-1 di kortika pêşiyê ya BPD de [69].
Di şîzofreniyê de, encamên lêkolînên ku li anormaliyên cytokine lêkolîn dikin nakok in (Table 2). Dema ku hin lêkolînan hem kêmbûna serumê pro-înflamatuar (IL-2, IFN-?) û hem jî zêde cytokines antî-înflamatuar serum û CSF (IL-10) dîtin [52], yên din cytokines pro- û antî-înflamatuar serumê bilind dîtin, bi serdestiya celebek proînflamatuar [22,173,174. ]. Yek meta-analîzek cytokine (62 lêkolîn, 2,298 şîzofreniya, 858 kontrolên saxlem) asta antagonîstê IL-1R, sIL-2R û IL-6 zêde kir [174]. Lêbelê, vê lêkolînê ji bo karanîna antîpsîkotîkan hesab nekir, ku tê fikirîn ku hilberîna cytokine ya proînflamatuar zêde dike [52]. Meta-analîzek cytokine ya nûtir (40 lêkolîn, 2,572 şîzofrenîk,4,401 kontrol) ku ji bo antîpsîkotîkan tê hesibandin, dîtin ku TNF-?, IFN-?, IL-12 û sIL-2R bi domdarî di şîzofreniya kronîk de serbixwe ji çalakiya nexweşiyê (nîşankerên taybetmendiyê) bilind dibin, dema ku IL-1?, IL-6 û veguherîna faktora mezinbûnê ya beta bi erênî bi çalakiya nexweşiyê re têkildar e (nîşankerên dewletê) [173]. Çandiniyên hucreyê yên hucreyên mononukleer ên xwînê yên derdor (PBMC) yên ku ji nexweşên şîzofrenîk hatine wergirtin astên bilind ên IL-8 û IL-1 hilberînin? bi xweber û hem jî piştî teşwîqkirina ji hêla LPS ve, di patholojiya şîzofreniyê de rolek ji bo monocytes / macrofages aktîfkirî pêşniyar dike [175].
Di OCD-ê de, encamên ji anketek rasthatî ya cytokines sera û CSF, û lêkolînên PBMC-ê-teşwîqkirî yên LPS, nakokî ne [93-95,176-179]. Têkiliyek di navbera OCD û polîmorfîzmek fonksiyonel de li herêma pêşverû ya TNF-? gene [34], her çend lêkolînên kêm-hêza vê yekê piştrast nekir [180]. Ji ber vê yekê, encamên tevlihev ên ji lêkolînên ku belge dikin TNF-? Asta cytokine [93,176-178] dibe ku tevlêbûna wan a guhêrbar a binkomê mijarên OCD-ê bi vê polîmorfîzma taybetî di hevbendên wan de nîşan bide.
Polarîzasyona Bersiva Sîtokîn Di Depresiyon û Şîzofreniya Mezin de
Fenotîpên bersivê yên sîtokîn li gorî fonksiyonên xweparastinê yên ku ew rêz dikin wekî Th1 (IL-2, IFN-?) an Th2 antî-înflamatuar (IL-4, IL-5, IL-10) têne dabeş kirin. Digel ku Th1 cytokines berevaniya hucreyê ya ku li dijî antîjenên hundurîn-hucreyî têne rêve kirin, Th2 cytokines bêrêziya humoral a ku li dijî antîjenên derveyî-hucreyî têne rêve kirin [29,52]. Sîtokînên Th1 ji hêla lymphocytes Th1 û monocytes M1 ve têne hilberandin lê cytokines Th2 ji hêla Th2 lymphocytes û M2 monocytes ve têne hilberandin [29,52]. Di mejî de, mîkroglia bi giranî cytokines Th1 derdixe, lê astroglia bi gelemperî cytokines Th2 derdixe [29,52]. Rêjeya berevajî ya sîtokînên Th1: Th2, ji vir pê ve �Th1-Th2 dîtbar,» bi rêjeya mîkroglia aktîfkirî (Th1 zêde) bi astroglia (Zêdetir Th2) û pêwendiya di navbera şaneyên T yên aktîfkirî û asta zêde ya glutamate ya CNS de ku me texmîn kir bandor dike. ji bo bersivdana Th1 xweş bike (Wêne 2) [29,163,166].
Nehevsengiya tîrêjê ya Th1-Th2 dikare bandorê li metabolîzma trîptofanê bike bi guheztina enzîmên wê [21,52] û bi vî rengî katabolîzma trîptofan ber bi kynurenine (KYN) û katabolîzma KYN ve ber bi her du metabolîtên wê yên jêrîn veguhezîne; mîkroglia quinolinic acid ku bi bersivê Th1 an asîda kynurenic astroglial (KYNA) ye (Wêne 1) ku bi bersiva Th2 ve girêdayî ye [21,29,170].
Enzîmên metabolîzma trîptofanê yên ku ji hêla Th1-Th2 ve têne bandor kirin ev in (Wêne 1): indoleamine 2,3-dioxygenase (IDO) ku ji hêla mîkroglia û astroglia ve têne diyar kirin, enzîmên sînorker ên ku navbeynkariya veguherîna trîptofanê bo KYN û serotonin bo 5- dike. asîda hîdroksîndoleacetîk[21,29]. Kynurenine 3-monooxygenase (KMO), ku bi tenê ji hêla mîkroglia ve tête diyar kirin, enzîma rêje-sînor e ku KYN vediguhezîne 3-hîdroksîkynurenîn (3-OH-KYN), ku bêtir bi asîda quinolinic ve tê metabolîze kirin [21,29]. Tryptophan-2,3-dioxygenase (TDO), ku tenê ji hêla astroglia ve tête diyar kirin, enzîma rêjeya-sînor e ku vediguherîne.trîptofan ji KYN [21,29]. Kynurenine aminotransferase (KAT), ku di serî de di pêvajoyên astroglial de tête diyar kirin, enzîma rêje-sînor e ku navbeynkariya veguherîna KYN bo KYNA dike [21,29].
Sîtokînên Th1 IDO û KMO mîkroglial çalak dikin, katabolîzma KYN ya mîkroglial ber bi quinolinic ve diguhezîne.senteza asîdê (agonîstê NMDAR), dema ku sîtokînên Th2 mîkroglial IDO û KMO çalak dikin, katabolîzma KYN astroglial ber bi senteza KYNA-ya navbeynkariya TDO- û KAT-ê (antagonîstê NMDAR) vediguhêze (Wêne 1) [21,29].
Th1 û Th2 immunofenotîpên serdest ji bo MDD û şîzofreniyê, bi rêzê ve, li ser bingeha nîgarên sîtokînên periferîkî, ne ji CNS, hatine pêşniyar kirin [52,173]. Em bawer dikin ku qalibên sîtokînên periferîkî nîşangirên surrogat ên nepêbawer ên yên di CNS de ne. Bi rastî, astên sîtokînên periferîkî dikarin ji hêla gelek guhêrbarên ekstra-CNS ve werin bandor kirin, ku di gelek lêkolînên cytokines ên periferîkî de bi domdarî nayên kontrol kirin, di nav de: 1) temen, nîşaneya girseya laş, dermanên psîkotropîk, cixare kişandin, stres û guheztinên dorhêlê; 2) bandora�çalakiya nexweşiyê / rewşa li ser hilberîna senteza sîtokînên hilbijartî [95,173]; û 3) bandorên ajanên psîkotropîk li ser hilberîna cytokines [52]. Nîv-jiyana kurt û zivirandina bilez a sîtokînên serumê [181] (mînak, 18 hûrdem ji bo TNF-? [182] beramberî 60 hûrdem ji bo IL-10 [183]), dibe ku pêbaweriya şirovekirina wan bêtir sînordar bike. astên ku ji nimûneyên sera yên rasthatî têne pîvandin.
Di MDD de, lihevhatinek heye ku bersivek Th1 immunophenotype ya proînflamatuar serdest e (Table 2) [17,29]. Asta bilind a asîdê quinolinic di mêjiyên MDD-ê yên piştî mirinê de [53], hebûna bertekek Th1-ya rêkûpêkkirî pêşniyar dike (Wêne 1) [21,29]. Asîda quinolinic a CNS-ê ya bilind dibe ku ketina kalsiyûmê bi navbeynkariya apoptoza astroglia ya mirovî pêşve bibe [184], ku bi hîpotezî dibe ku vê nexweşiyê sist bike.Bersiva Th2 ya ku ji astroglia-derketî [29], Th1 li hember Th2 balansa xwe di berjewendiya bersiva Th1 ya mîkroglial de vedigire. Hîposerotonergiya CNS [29] piştgiriyek din li bersivek zêde ya Th1 zêde dike, ku tê destnîşan kirin ku senteza serotonin CNS [185] kêm dike û hilweşîna wê zêde dike (Wêne 1) [21,29].
CNS hyperglutamatergia di heman demê de dibe ku bibe sedema bersivek zêde ya Th1 di mêjî de (Wêne 2). Lêkolînek in vitro destnîşan dike ku lîmfosîtên T yên dorhêlî bi rêgez receptorê glutamate yê metabotropîk 5 (mGluR5) [164] îfade dikin, ku girêdana wê bi glutamate re serbestberdana IL-6 lîmfosîtîkî asteng dike, bi vî rengî pêşkeftina şaneya T-efektorê ya oto-reaktîf kêm dike [164]. Lîmfosîtên T yên aktîfkirî, lê lîmfosîtên T yên bêhnfireh, dikarin BBB derbas bikin [37].
Daneyên ezmûnî destnîşan dikin ku pêwendiya di navbera receptorên hucreya T yên lîmfosîtên T-ya çalakkirî û şaneyên wan ên antîgenê yên naskirî de dikare mGluR5 kêm bike û îfadeyên mGluR1 bike [164]. Di modelên heywanan de, girêdana glutamate ya zêde bi receptorên mGluR1 yên lîmfosîtîk re hilberîna sîtokînên Th1, tevî IFN-? [164].
Em hîpotez dikin ku di hin nexweşên MDD de, paralelî daneyên ceribandinê [164], girêdana glutamate ya CNS ya zêde bi receptorên mGluR1 yên lîmfosîtîkî ve dibe ku bibe sedema bersivek zêde ya Th1, tevî IFN-? (Şikil 2). Em texmîn dikin ku IFN-? di mîqdarek piçûk de, mîna bandorên wê yên in vitro yên li ser mîkroglia [166], dibe ku îfadeya mîkroglial ya MHC-II û EAAT2 [163,166] çêbike, dihêle ku mîkroglia wekî şaneyên pêşkêşkerê antîjenê yên naskirî bixebite û fonksiyona vegirtina glutamate peyda bike [163,164,166], bi vî rengî mîkroglia zirardar vediguhezîne fenotîpek neuroprotektîf [163,166] ku beşdarî rakirina glutamate ya derveyî hucreyî ya zêde [163,164,166] dibe. Ji ber vê yekê, em di heman demê de hîpotez dikin ku bersiva zêde ya Th1 di binkomên nexweşên MDD de şûrek du-devî ye, iltîhaba zirardar pêşve dike û wekî mekanîzmayek dijber-rêkûpêk a bikêr e ku dibe ku neuroexcitotoxicity-a girêdayî glutamate-ya zêde sînordar bike (Wêne 2).
Di şîzofreniyê de, dema ku hin lêkolînên cytokine yên periferîkî serdestiya antî-înflamatuar Th2 immunophenotip / bersiv [52] pêşniyar dikin, yên din vê yekê red dikin [173,174]. Lêbelê, em bi nivîskarên ku hîpotez kirin re hevî dikin ku bersiva Th2 di şîzofreniyê de fenotîpa serdest e [52]. Asta bilindbûna mêjî, CSF, û serumê ya KYNA [21,52] kêmkirina mîkro-glial IDO û KMO pêşniyar dike, ku fonksiyonek bersiva Th2 ye ku katabolîzma KYN astroglial ber bi senteza KYNA ve diguhezîne (Wêne 1) [21,52]. Kêmbûna çalakiya KMO û îfadeya mRNA ya KMO di mêjiyên şîzofrenîk ên piştî mirinê de [73] bi bersiva zêde ya Th2 re hevaheng e (Wêne 1). Di binkomên nexweşên şîzofreniyê de berbelavbûna zêdebûna anormaliyên berevaniya humoral a bi navbeynkariya Th2-ya ku ji hêla zêdebûna hejmarên hucreyên B ve hatî xuyang kirin [21,76], zêde bû.hilberîna otoantîbodîyan di nav de antîpên antiviral [76] û zêdekirina immunoglobulin E [52]-piştgiriyek din li hîpoteza serdestiya bersiva Th2 zêde dike.
Neuroinflammation & Nerazîbûna Glutamate ya CNS
Glutamate navbeynkar û tevgerê dike [186]. Asta glutamatê ya synaptîk ji hêla EAAT-ên glial û neuronal ên girêdayî sodyûm-girêdayî yên bilind ve têne rêve kirin, nemaze, pergala XAG- berpirsiyarê vegirtina glutamate / serbestberdana aspartate [137,164] û pergala antîporter astroglial glutamate / cystine-serbixwe ji sodyûmê (Xc-) berpirsiyarê berdana glutamate / vegirtina cystine [164]. Astroglial EAAT1 û EAAT2 zêdetirî 90% ji nûvegirtina glutamate peyda dikin [79].
Neuroinflammasyon dikare metabolîzma glutamate û fonksiyona veguhêzên wê biguhezîne [15,29,187,188], ku kêmasiyên cognitive, behre û derûnî çêbike [15,21,29,79,186,188,189]. Nerazîbûnên fonksiyonê / derbirîna EAATs û metabolîzma glutamate di MDD, BPD, şîzofreniya, û OCD de di Tablo 2 de têne kurt kirin.
Di MDD de, delîl ji bo hyperglutamatergia kortikal heye (Table 2). Asta glutamate ya kortikal bi giraniya nîşanên depresyonê re erênî têkildar bû, û qursek pênc-hefte ya antîdepresan tansiyonên glutamate yên serumê kêm kir [85,86]. Yek dozek ketamine, antagonîstek bihêz a NMDAR, dikare hefteyek MDD-ya reaksiyonê berevajî bike [17,21,29,85]. Zêdebûna asta glutamate ya CNS dikare bibe sedema iltîhaba bi navbeynkariya neurotoksîkî [163,164,188], di nav de bersivek Th1 ya proînflamatuar (Wêne 2) [164].
Delîlên tixûbdar ên in vitro destnîşan dikin ku sîtokînên iltîhab/proînflamatuar dikarin asta glutamate ya CNS [188] di çerçoveyek vejen-pêşverû de bi navgîniya çend mekanîzmayên potansiyel zêde bikin: 1) sîtokînên proînflamatuar dikarin [15,17,168] asteng bikin û [45,137] glutamate-astroglial EAAT-navbeynkar berevajî bikin. fonksiyona veguhestinê; 2) Sîtokînên proînflamatuar dikarin senteza asîda quinolinic mîkroglial [53] zêde bikin, ku bi ezmûnî hate destnîşan kirin ku serbestberdana glutamate ya synaptosomal pêşve dike [15,17,29,190]; 3) COX-2 / PGE-2 û TNF- zêde kirin? ast dikare ketina kalsiyûmê bike [137], ku, li ser bingeha daneyên in vitro, dibe ku glutamate astroglial û serbestberdana D-serine zêde bike [191]; û 4) mîkroglia aktîfkirî dikare pergalên Xc- antiporter ên zêde yên ku serbestberdana glutamate navbeynkariyê dikin diyar bike [164,192].
Di şîzofreniyê de, hîpoglutamatergiya cortical prefrontal [87,90,193,194] (Table 2) û fonksiyona NMDAR kêmkirî tê dîtin [5]. Meta-analîza spektroskopiya rezonansa magnetîkî ya H1 (MRS) ya dawî (28 lêkolîn, 647 şîzofreniya, 608 kontrol) kêmbûna glutamate û zêdekirina asta glutamine di korteksa eniya navîn de piştrast kir [90]. Rola beşdariya iltîhaba hîpoglutamatergia nehatiye îsbat kirin. Di mejiyên şîzofreniyê de senteza KYNA ya bilind [21,52], bi gelemperî fonksiyonek bersiva Th2 (Wêne 1), dikare li jêr yekîneya NR1 ya NMDAR û alpha 7 nîkotînî asteng bike.receptora acetylcholine (?7nAchR) [195], dibe sedema kêmbûna fonksiyona NMDAR û kêmkirina serbestberdana glutamate ya bi navbeynkariya ?7nAchR [195].
Di BPD û OCD de, dane di her du nexweşiyan de hîper-glutamatergiya kortikal a CNS-ê pêşniyar dikin (Table 2) [78,84,88,131]. Tevkariya iltîhaba (BPD û OCD) û otoantîbodîyan (OCD) [7,77,84,88,130] ji bo zêdekirina asta glutamate ya CNS hewce dike ku bêtir lêkolîn bike.
Rola S100B
S100B proteînek kalsiyûmê ya 10 kDa ye ku ji hêla astroglia, oligodendroglia, û şaneyên ependîmal ên choroid plexus ve hatî hilberandin [196]. Ew bandorên xwe li ser neuronên derdorê û glia bi navgîniya receptorê ji bo hilberîna dawiya glycation ya pêşkeftî [196] navbeynkar dike. Asta S100B ya derveyî hucreyî ya nanomolar bandorên neurotrofîkî yên bikêr peyda dike, birîna neuronal a girêdayî stresê sînordar dike, TNF-ya mîkroglial asteng dike? berdan, û vegirtina glutamate astroglial zêde bike [196]. Girêdanên mîkromolar S100B, ku bi giranî ji hêla astroglia û lîmfosîtên aktîfkirî ve têne hilberandin [196,197], xwedî bandorên zerardar ên ku ji hêla receptorê ve ji bo hilberê dawiya glycasyonê ya pêşkeftî ve hatî veguheztin ku di nav de apoptoza neuronal, hilberîna COX-2 / PGE-2, IL-1 heye? û cureyên oksîdê nîtricê yên înducable, û bilindkirina TNF-ya monosîtîk/mîkroglial? veşartî [21,196,198].
Serum û, nemaze, CSF û asta S100B tevna mêjî nîşaneyên çalakkirina glial (bi piranî astroglial) in [199]. Di MDD û psîkozê de, astên S100B yên serumê bi giraniya xwekuştinê re, serbixwe ji teşhîsa derûnî ve girêdayî ye [200]. Analîzkirina piştî mirinê ya S100B di kortikê pêşgotina dorso-lateralî ya MDD û BPD de kêmbûn nîşan da, û di korteksa parietal a BPD de ast zêde bû [196].
Meta-analîz (193 nexweşiya moodê, 132 kontrolên saxlem) bilindbûna asta serum û CSF S100B di nexweşiyên moodê de, nemaze di dema serpêhatiyên depresyonê yên akût û mania de piştrast kir [201].
Di şîzofreniyê de, mêjî, CSF û asta S100B ya serumê bilind dibin [199,202]. Meta-analîz (12 lêkolîn, 380 şîzofreniya, 358 kontrolên saxlem) bilindbûna asta S100B ya serumê di şîzofreniyê de piştrast kir [203]. Di mejiyên paş-mirinê yên mijarên şîzofreniyê de, astroglia S100B-immunoreaktîf li deverên ku di şîzofreniyê de têkildar in, di nav de korteksa cingulate ya pêşîn, korteksa pêşîn a dorsolateral, korteksa orbitofrontal û hîpocampi [154] têne dîtin. Asta bilindbûna S100B bi paranoîd [154] û psîkoza negatîf [204], têgihîştina astengdar, bersiva dermankirinê ya belengaz û dirêjahiya nexweşiyê [202] re têkildar e. Polîmorfîzma genetîkî ya di S100B [32] û receptorê ji bo genên hilberîna dawîn a glycasyonê ya pêşkeftî ya di kolektîfên şîzofreniyê de (Table 2) [32,33,205] pêşniyar dikin ku ev anormalî îhtîmal e ku seretayî / pathogenîk in ne yên duyemîn / biyomarkerên. Bi rastî, kêmbûna asta S100B ya serumê piştî dermankirina bi antîdepresanan [201] û antîpsîkotîkan [196] pêşniyar dike.hin pêwendiya klînîkî ya S100B bi pathofîzyolojiya nexweşiyên derûnî re.
Neuroinflammation & Zêdebûna Stresa Oksîdatîf
Stresa oksîdatîf rewşek e ku tê de zêdebûnek oksîdan zirarê dide makromolekulên biyolojîkî yên wekî lîpîd, proteîn û DNA [206-209]. Ev zêdebûn ji zêdebûna hilberîna oksîdan, kêmbûna jêbirina oksîdan, berevaniya antîoksîdan a nebaş, an hin tevliheviya wan pêk tê [206-209]. Mêjî bi taybetî ji stresa oksîdatîf xeternak e ji ber: 1) bilindbûna mîqdarên asîdên rûn ên polyunsaturated peroxidizable; 2) naveroka nisbeten bilind a mîneralên şopî yên ku peroksîda lîpîdê û radîkalên oksîjenê çêdikin (mînakî, hesin, sifir); 3) karanîna oksîjenê ya bilind; û 3) mekanîzmayên antî-oksîtasyonê yên tixûbdar [206,207].
Stresa oksîdative ya zêde dikare di MDD [206], BPD [206,207], şîzofreniya [207,209], û OCD [206,208] de çêbibe. Nîşaneyên periferîkî yên astengiyên oksîtasyonê zêdekirina hilberên peroksîdana lîpîdê (mînakî, malondialdehyde û 4-hîdroksî-2-nonenal), zêdebûna metabolîtên nîtrîk oxide (NO), kêmbûna antîoksîdan (mînakî, glutathione) û guheztina astên enzîma antîoksîdan [206,207] hene.
Di MDD de, zêdebûna hilberîna anionê ya radîkal a superoksîdê bi zêdebûna apoptoza neutrofîl a bi navbeynkariya oksîdasyonê re têkildar e [206]. Asta serumê ya enzîmên antîoksîdan (mînakî, superoxide dismutase-1) di dema serpêhatiyên depresîv ên akût de zêde dibin û piştî dermankirina bijartî ya vegerandina serotonin (SSRIs) normal dibin [206]. Ev pêşniyar dike ku di MDD de, asta enzîma antîoksîdan a serum nîşanek dewletê ye, ku dibe ku mekanîzmayek tezmînatê ya ku li hember zêdebûna akût di stresa oksîdasyonê de radiweste nîşan bide. [206]. Berevajî vê, di şîzofreniyê de, astên superoxide dismutase-1-ê yên CSF-ê yên çareserkirî di nexweşên şîzofrenîk ên zû-destpêkirî de li gorî nexweşên şîzofrenîkî yên kronîk û kontrolên saxlem bi giranî kêm dibin. Ev pêşniyar dike ku kêmbûna asta enzîma antîoksîdan a mêjî dibe ku di şîzofreniya akût [210] de bibe sedema zirara oksîdative, her çend lêkolînên mezintir hewce ne ku vê vedîtinê piştrast bikin.
Gelek lêkolînên ceribandî û mirovî yên din bi hûrgulî mekanîzmayên di binê patofîzyolojiya zêdebûna stresa oksîtasyonê de di nexweşiyên derûnî de lêkolîn kirin [206-262]. Di modelên heywanan ên depresyonê de, asta mêjî ya glutathione kêm dibe dema ku peroksîda lîpîdê û astên NO zêde dibin [206,262].
Lêkolînên postmortem di MDD, BPD [206] û mijarên şîzofrenîk [206,207] de asta mêjî ya glutathione ya tevahî kêm kêm dike. Fibroblastên ku ji nexweşên MDD têne çandin, stresa oksîdasyonê ya serbixwe ji astên glutathione [262] nîşan didin, ku li dijî rola bingehîn a kêmbûna glutathione wekî mekanîzmaya sereke ya stresa oksîdative di depresyonê de nîqaş dikin.
Çalakkirina mîkroglial dibe ku bi hilberîna wê ya sîtokînên proînflamatuar û NO [206-209] stresa oksîdative zêde bike. Sîtokînên proînflamatuar û astên bilind ên NO dibe ku avakirina cureyên oksîjenê yên reaktîf (ROS) pêşve bibin, ku di encamê de peroksîda lîpîdê lez dike, zirarê dide fosfolîpîdên membranê û receptorên neurotransmitter monoamine-girêdayî wan û antîoksîdanên endojen kêm dike. Zêdebûna hilberên ROS-ê dikare aktîvkirina mîkroglial zêde bike û hilberîna proînflamatuar bi navgîniya NF-?B [208] zêde bike, ku di encamê de birîna oksîdative [208] dom dike, di hin nexweşiyên derûnî de potansiyelek vegerek erênî ya patholojîkî diafirîne [206-209]. Her çend neuroinflammasyon dikare asta glutamate ya mêjî zêde bike [85,86], rola hîperaktîvîteya glutamatergîk wekî sedemek stresa oksîdative bêbawer dimîne [207].
Di MDD, BPD û şîzofreniyê de xerabûna mitochondrial dibe ku bibe sedema zêdebûna stresê oksîdative [206]. Lêkolînên postmortem ên di van nexweşiyan de anormaliyên di DNA-ya mitochondrial de eşkere dikin, ku bi berbelavbûna zêde ya astengiyên derûnî yên di nexweşiyên mîtokondrî yên bingehîn de pêk tê [206]. Lêkolînên heywanan ên in vitro destnîşan dikin ku cytokinesên proînflamatuar, wekî TNF-?, dikarin dendika mitochondrial kêm bikin û metabolîzma oksîterî ya mitochondrial [211,212] xera bikin, ku dibe sedema zêdebûna hilberîna ROS [206,213]. Van vedîtinên ceribandî dibe ku têkiliyên mekanîkî yên di nav neuroînflamasiyonê, xerabûna mîtokondrîal û stresa oksîdative [206,213] de nîşan bidin, ku hêjayî lêkolîna bêtir a van riyên pathogenîk ên hevberkirî di nexweşiyên derûnî yên mirovî de ne.
Zehfbûna tevna nervê ya ji zirara oksîtasyonê di nav nexweşiyên derûnî yên cihêreng de li ser bingeha rêgezên neuroanatomîkî, neurokîmyayî û molekulî yên ku di nexweşiya taybetî de têkildar in diguhere [207]. Dibe ku bandorên dermankirinê jî krîtîk bin, ji ber ku delîlên pêşîn destnîşan dikin ku antîpsîkotîk, SSRIs û stabîlkerên moodê xwedan taybetmendiyên antîoksîdan in [206,207,262]. Rola dermankirinê ya antîoksîdanên adjuvant (mînakî, vîtamînên C û E) di nexweşiya derûnî de dimîne ku ji hêla ceribandinên klînîkî yên rasthatî yên bi hêz-bilind ve were piştrast kirin. N-acetylcysteine heya îro encamên herî hêvîdar nîşan dide, digel çend ceribandinên randomkirî yên bi cîhbo-kontrolkirî de bandora wê di MDD, BPD û şîzofreniyê de destnîşan dikin [207].
Kêmasiya Astengiya Xwîn-Mejî
BBB bi sînorkirina têketina navbeynkarên înflamatuar ên periferîkî, di nav de cytokines û antîbodên ku dikarin neurotransmission asteng bikin, statûya xweparastinê ya mêjî ewle dike [214,215]. Hîpoteza perçebûna BBB û rola wê di hin nexweşên derûnî de [60,214,216,217] bi zêdebûna berbelavbûna tevliheviya derûnî ya di nexweşiyên ku bi xerabûna wê ve girêdayî ne re têkildar e, di nav de SLE [97], stok [11],epîlepsî [218] û encefalîtîdên otoîmmune (Table 1). Di nexweşên bi MDD û şîzofreniyê de bilindbûnek �CSF: Rêjeya albumîna serumê ya serumê de zêdebûna permeability BBB [214] pêşniyar dike.
Di lêkolînek de (63 mijarên derûnî, 4,100 kontrol), anormaliyên CSF yên ku zirara BBB-ê nîşan didin di 41% ji mijarên derûnî de (14 MDD û BPD, 14 şîzofreniya), di nav de senteza hundurîn a IgG, IgM, û/an IgA, hatin tespît kirin. pleocytosis CSF ya sivik (5 heta 8 hucreyên per mm3) û hebûna heya çar bandên oligoclonal ên IgG [216]. Yek lêkolînek ultrastruktural a piştî mirinê di şîzofreniyê de anormaliyên ultrasructural BBB di kortikên pêşrû û dîtbar de, ku tê de dejenerasyona vakuolê ya hucreyên endothelial, pêvajoyên astroglial-end-ling-, û stûrbûn û nerêkûpêkiya lamîna bingehîn vedihewîne, eşkere kir [60]. Lêbelê, di vê lêkolînê de, nivîskaran li ser beşdariya potansiyela guhertinên postmortem li ser dîtinên xwe şîrove nekir. Lêkolînek din ku lêkolîna transkriptomîkên hucreyên endotelî yên BBB di mejiyên şîzofrenîk de cûdahiyên girîng di nav genên ku bandorê li fonksiyona immunolojîk dikin, yên ku di kontrolan de nehatin tespît kirin nas kir [217].
Kêmasiya endotelî ya bi navbeynkariya oksîdasyonê dibe ku di nexweşiyên derûnî de beşdarî patofîzyolojiya xerabûna BBB bibe. Delîlên nerasterast ji lêkolînên klînîkî û ezmûnî yên di depresyonê de [219] û, bi dereceyek hindiktir, di şîzofreniyê de [220] destnîşan dikin ku zêdebûna oksîdasyonê dibe ku beşdarî xerabûna endothelial bibe. Kêmasiya endothelial dibe ku mekanîzmayek hevpar nîşan bide ku têkiliyek naskirî ya di navbera depresyonê û nexweşiya dil [219,221] de tê hesibandin, ku dibe ku bi kêmbûna asta vasodilator NO [221-223] ve girêdayî be. Lêkolînên ceribandî destnîşan dikin ku kêmbûna asta NO ya endothelial bi mekanîzmakî ve girêdayî ye bi veqetandina synthase ya nîtrîkî ya endotelyal (eNOS) ji hev-faktora wê ya bingehîn tetrahydrobiopterin (BH4), ku substrata xwe ji L-argînîn ber bi oksîjenê ve diguhezîne [224-226]. ENOS-ya nehevkirî senteza ROS (mînak, superoksît) û celebên nîtrojenê reaktîf (RNS) (mînak, peroksînitrite; hilberek ji hevberdana superoksîtê bi NO) [227] ji bilî NO pêşve dike, ku dibe sedema xerabûna endotelî ya bi navbeynkariya oksîdasyonê [224] 226-XNUMX].
Daneyên heywanan destnîşan kir ku SSRIs dikarin asta NO ya endothelial ya kêm [219] vegerînin, pêşniyar dike ku mekanîzmayên antî-oxidative dibe ku beşdarî bandorên wan ên antîdepresan bibin. Di mirovan de, L-methylfolate dibe ku bandorên antî-depresantî yên SSRIs [228] xurt bike, bi texmînî bi zêdebûna asta BH4, ku ji bo antî-oksîdasyona bi navbeynkariya eNOS-ê ji nû ve-hevberdanê [229], û her weha ji bo rêjeyê kofaktorek bingehîn e. -enzîmên sînordar ên monoamine (ango, serotonin, norepinephrine, dopamine) senteza [228].
Bi hev re, hem xebata dawîn ku balê dikişîne ser rola stresa oksîdatîf a nehevkirî ya eNOS-ê di pathogenesis nexweşiyên damarî de [230,231] û…Lêkolînên epîdemîolojîkî ku depresyonê wekî faktorek xeternak a serbixwe ji bo patholojiyên damaran, wek strok û nexweşiya dil [219,221] destnîşan dikin, piştgirîyek din li pêwendiya klînîkî ya zirara oksîterî ya endotelî ya nehevkirî ya eNOS-ê di depresyonê de zêde dike. Tevî gelek delîlên ji bo anormaliyên sîtokîn ên di nexweşiyên derûnî yên mirovî de û daneyên ceribandinê yên ku destnîşan dikin ku sîtokînên proînflamatuar dikarin îfadeya eNOS [212] kêm bikin û permebûna BBB [215] zêde bikin, delîlên mirovî ku rasterast cytokinesên proînflamatuar ên zêde bi xerabûna eNOS û/an kêmbûna BBB ve girêdidin. kêmbûn.
Di Nexweşiya Psîkiyatrîk de Nîgarkirin & Dermankirina Inflammasyonê
Nîgarkirina Neuroinflammation Li Situ
Ji hêla klînîkî ve, wênekêşiya neuroinflammasyonê dibe ku ji bo destnîşankirina binkrûba nexweşên derûnî yên bi neuroînflamasiyonê re ku bi îhtîmalek mezin bersivê bidin dermanên immunomodulatory girîng girîng be. Wekî din, wênekêşiyek wusa dibe ku bijîjkan bihêle ku çalakiya nexweşiya têkildar bi neuroinflammasyonê û bersiva wê ya li ser dermankirina berevaniyê di nexweşên derûnî de bişopînin. Wêneya iltîhaba di mejiyê mirov de bi kevneşopî bi dîtbarîkirina MRI an CT-ê ya berevajîyên hundurîn ên ekstravagated ve girêdayî ye, ku perçebûna herêmî ya BBB destnîşan dike. MRI-ya zêdekirî ya gadolinium carinan di nav deverên lîmbîk ên ku bi pêvajoyek hestyarî re têkildar in di nexweşên bi nexweşiyên derûnî yên ku ji ber paraneoplastîk an encefalîtîdên din ve têne veqetandin nîşan dide [107,109,113]. Li gorî zanîna me, lêbelê, pêşkeftina ne normal di tu nexweşiyek derûnî ya klasîk [21,214,232] de, tevî anormaliyên BBB yên fonksiyonel [214,216] û ultrastrukturî [60] nehatiye xuyang kirin.
Di nexweşiyên derûnî yên klasîk de gelo neuroinflammasyona naziktir dikare di vivo de were xuyang kirin an na, nenas dimîne. Teknîkîyek sozdar tomografiya emîsyona pozitronê (PET) e ku bi karanîna radyotraceran, wek C11- PK11195, ku bi proteîna translocator ve girêdide, ku berê wekî receptorê benzodiazepine yê periferîkî tê zanîn, ku ji hêla mîkroglia aktîfkirî ve hatî xuyang kirin [233,234].
Bi karanîna vê rêbazê, nexweşên bi şîzofreniya xwedan çalakiyek mîkroglial a mezintir li seranserê kortikê [235] û di hîpokampusê de di dema psîkoza akût [236] de hate destnîşan kirin. Lêkolînek (14 şîzofreniya, 14 kontrol) ti cûdahiyek girîng di navbera girêdana [11C] DAA1106 di şîzofreniyê de li hember kontrolan de nedît, lê têkiliyek rasterast di navbera girêdana [11C] DAA1106 û giraniya nîşanên erênî û dirêjahiya nexweşiyê di şîzofreniyê de [236].
Lêkolînerên ji saziya me C11-PK11195 PET bikar anîn da ku iltîhaba bi-hippocampal li nexweşek bi xerabûna neuropsîkiyatrî, di nav de MDD psîkotîk, epîlepsî, û amneziya anterograde, ku bi antî-GAD-ê ve girêdayî ye, nîşan bide [237]. Lêbelê, PK11195 PET heyetaybetmendiyên sînyala-to-deng kêm û pêdivî bi cyclotron li ser malpera.
Li gorî vê yekê, lêkolîn ji bo pêşvebirina lîgandên proteîna translocator çêtir ên ji bo PET û SPECT tê terxan kirin. Lêkolînên paşerojê yên bi hêz û hêzdar ên tevnvîsên mêjî yên piştî mirinê bi karanîna mîqdarkirina proteînê bi mebesta ronîkirina rêyên metabolîk û înflamatuar, sîtokînên CNS û receptorên wan ên girêdanê, di nexweşiyên derûnî de hewce ne ku têgihîştina me ya pathofîzyolojiya otoîmmune pêş bixin.
Rola Dermanên Antîînflamatuar Di Nexweşiyên Psîkiyatrîk de
Gelek lêkolînên mirov û heywanan destnîşan dikin ku hin dermanên antî-înflamatuar dikarin di dermankirina nexweşiyên derûnî de rolek alîkariyek girîng bilîzin (Table 3). Dermanên hevpar inhibîtorên cyclooxygenase (Table 3) [238-245], minocycline (Table 3) [240-245], asîdên rûn ên omega-3 [246,247], û neurosteroids [248] ne.
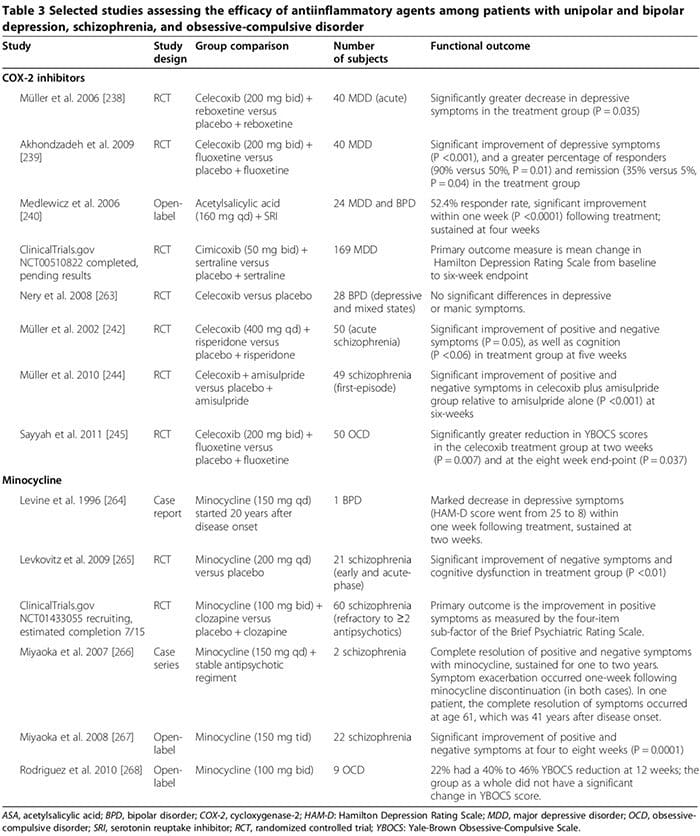 Gelek lêkolînên mirovî destnîşan kirin ku astengkerên COX-2 dikarin nîşanên derûnî yên MDD, BPD, şîzofreniya û OCD çêtir bikin (Table 3) [248]. Berevajî vê, dermankirina pêvek bi înhîbîtorên COX-ê yên ne-bijartî (ango, dermanên dijî-înflamatuar ên ne-steroîdal (NSAIDs)) dibe ku bandora SSRI kêm bike [249,250]; du ceribandinên mezin ragihandin ku rûbirûbûna NSAIDs (lê ne ji frensiyonên COX-2 yên bijartî an salicylates) re bi xirabûnek girîng a depresyonê re di nav komek beşdarên lêkolînê de têkildar bû [249,250].
Gelek lêkolînên mirovî destnîşan kirin ku astengkerên COX-2 dikarin nîşanên derûnî yên MDD, BPD, şîzofreniya û OCD çêtir bikin (Table 3) [248]. Berevajî vê, dermankirina pêvek bi înhîbîtorên COX-ê yên ne-bijartî (ango, dermanên dijî-înflamatuar ên ne-steroîdal (NSAIDs)) dibe ku bandora SSRI kêm bike [249,250]; du ceribandinên mezin ragihandin ku rûbirûbûna NSAIDs (lê ne ji frensiyonên COX-2 yên bijartî an salicylates) re bi xirabûnek girîng a depresyonê re di nav komek beşdarên lêkolînê de têkildar bû [249,250].
Di ceribandina yekem de, bi tevlêbûna 1,258 nexweşên depresyonî yên ku 12 hefte bi citalopram re hatine derman kirin, rêjeya paşketinê di nav wan kesên ku bi kêmanî carekê NSAIDs bikar anîne li gorî yên ku nexwestine (45% li hember 55%, OR 0.64, P = pir kêmtir bû. 0.0002) [249]. Ceribandina din, ku 1,545 mijarên MDD-ê vedihewîne, destnîşan kir ku rêjeya depresyona berxwedêr a dermankirinê di nav wan kesên ku NSAIDs digirin de pir zêde bû (OR 1.55, 95% CI 1.21 heta 2.00) [231]. Xirabbûna depresyonê di komên NSAID-ê de dibe ku ji hêla mekanîkî ve bi dermankirina NSAID-ê ve neyê girêdan lê li şûna wê bi şert û mercên bijîjkî yên kronîk ên hev-heyî ve girêdayî ye [10,12-18] ku hewcedariya NSAID-yên demdirêj hewce dike û yên ku têne zanîn ku bi serbixwe ve girêdayî ne. rîska depresyona berxwedêr a dermankirinê zêde bû [249,251]. Lêkolînên paşerojê yên ku li ser bandora NSAIDs li ser depresyonê û bersiva antîdepresanan di mirovan de lêkolîn dikin hewce ne.
Di lêkolînên ceribandî yên din de ku paradîgmayên stresa akût bikar tînin da ku di mişkan de rewşek depresyonê-depresyonê derxînin, citalopram TNF-?, IFN-?, û p11 (faktora molekulî ya ku bi behreya depresîf a heywanan ve girêdayî ye) di kortika pêşîn de zêde kir, dema ku NSAID ibuprofen. van molekulan kêm kirin; NSAIDs di heman demê de bandorên antîdepresant ên SSRIs jî kêm kirin lê ne antîdepresantên din [249]. Van dîtinan destnîşan dikin ku cytokines pro-înflamatuar dibe ku bi paradoksî bandorên antîdepresantî bikin tevî delîlên mezin ji…lêkolînên mirovî berevajî (wekî ku li jor hatî nihêrîn), ku dikare ji hêla NSAIDs ve were kêm kirin [249]. Bi kêmî ve du nêrîn dikarin ji bo vê paradoksa diyar hesab bikin: 1) di bin hin şert û mercên ceribandinê de, sîtokînên proînflamatuar bi rolek neuroprotektîf re têkildar bûne, [251; (ji bomînak, IFN-? di astên nizm de dikare mîkroglia neuroprotektîf bike (Wêne 2) [163,166,251]); û 2) gelo ev bersivên ku di çarçoweya paradîgmayek stresê ya tûj de di modelek heywanan de têne dîtin ji bo MDD-ya endogenous di mirovan de ne diyar e [251].
Bandorên dermankirinê yên înhîbîtorên COX-2 di nexweşiyên derûnî de dibe ku modulasyona biosenteza prostaglandînên COX-2-derketî, di nav de PGE2 proînflamatuar û 15-deoxy-?12,14-PGJ2 (15d-PGJ2) antî-înflamatuar jî hebe [252,253]. Inhibitors COX-2 dikarin iltîhaba navbeynkariya PGE2 kêm bikin, ku dibe ku beşdarî patofîzyolojiya nexweşiyên derûnî bibe [252,253]. Di heman demê de ew dikarin astên 15d-PGJ2, û çalakiya wê ya receptora navokî ya gama-ya receptora navokî ya proliferator-aktîfkirî ya peroxisome (PPAR-?) [252,253] biguherînin.
Gelek lêkolîn pêşniyar dikin ku 15d-PGJ2 û receptorê wê yê nukleerî PPAR-? dikare wekî nîşankerên biyolojîkî ji bo şîzofreniyê bixebite [253]. Di nexweşên şîzofrenîk de, asta PGE2 di serumê de zêde dibe, lê asta serumê ya 15d-PGJ2 kêm dibe, wekî diyardeya receptora wê ya nukleerî PPAR-? li PBMC [252]. Gava ku înhîbîtorên COX-2 dikarin bandorên antî-înflamatuar ên potansiyel ên bikêr ên COX-2-girêdayî �15d-PGJ2/PPAR- sînordar bikin? rê…, ew dikarin bi avantaj bandorên wê yên zerardar kêm bikin, di nav de 1) zêdebûna metirsiya enfarkteya myokardial û hin enfeksiyonan (mînak, cytomegalovirus û Toxoplasma gondii) di nexweşên şîzofrenîk [254] û 2) bandorên wê yên pro-apoptotîk ên ku di nav de têne dîtin. tevna penceşêrê ya mirov û heywanan [255]. Mekanîzmayên din ên potansiyel ên bandorên dermankirinê yên frendêrên COX-2 dibe ku şiyana wan a kêmkirina astên sîtokînên proînflamatuar [163], sînordarkirina excitotoksîkî ya asîdê quinolinic (wek MDD) û kêmkirina astên KYNA (wek şîzofreniyê) [128].
Minocycline dikare di nexweşiyên derûnî de bi bandor be (Table 3) [248]. Daneyên in vitro destnîşan dikin ku minocycline MAP, derziya cytokine, �COX-2/PGE-2 îfadeya,� û oksîdê nîtrîk synthase ya înducable asteng dike [256]. Minocycline dikare di heman demê de neurotransmissiona glutamatergîk û dopaminergîk a bêrêkûpêk berevajî bike [256].
Bandora asîda rûnê ya Omega-3 di nexweşiyên derûnî de ne diyar e [248]. Di sala 2011-an de meta-analîzek ji 15 ceribandinên randomkirî-kontrolkirî (916 MDD), lêzêdekirinên omega-3 yên ku asîda eicosapentaenoic ?60% dihewîne (navbera dozê ji 200 heta 2,200 mg/d ji zêdeyî dozaja docosahexaenoic acidê) bi girîngî kêm kir. tedawiya pêvek ji bo SRIs (P <0.001) [246]. Lêbelê meta-analîzek paşîn, encam da ku di depresyonê de feydeyek girîng a asîdên rûn ên omega-3 tune ye û ku bandoriya ku tê xuyang kirin tenê encamek bertengiya weşanê ye [247]. Meta-analîzek 2012-ê ya 5 ceribandinên randomkirî-kontrolkirî di nav de 291 beşdarên BPD-ê jî dît ku nîşanên depresîv, lê ne manîkî, di nav wan ên ku ji asîdên rûn ên omega-3 re rasthatî bûne li gorî yên ku cîhêbo digirin bi girîngî çêtir bûne (Hedges g 0.34, P = 0.025). [257]. Di ceribandinek kontrolkirî ya rasthatî ya mijarên şîzofrenîkî de ku heya 12 mehan hat şopandin, hem xalên nîşaneyên erênî hem jî neyînî di nav 66 beşdaran de ku ji omega-3-zincîra dirêj re rasthatî hatin kêm kirin (1.2 g/roj ji bo 12 hefte; P = 0.02 û 0.01, bi rêzê ve) [258]; the�nivîskaran encam da ku zêdekirina omega-3 di dema destpêka şîzofreniyê de jî dikare pêşî li paşveçûn û pêşveçûna nexweşiyê bigire [258].
Meta-analîzek 2012 ya heft ceribandinên randomkirî-kontrolkirî yên ku zêdekirina omega-3 di 168 nexweşên şîzofrenîk de dinirxîne tu feydeya dermankirinê nedît [259]. Nivîskarên vê meta-analîzê bi taybetî diyar kirin ku di derbarê pêşîlêgirtina vegerê an xalên dawiya pêşkeftina nexweşiyê de ti encamek nayê derxistin [259]. Daneyên ezmûnî destnîşan dikin ku eicosapentaenoic acid û docosahexaenoic acid bandorên xwe yên dijî-înflamatuar bi pêşvebirina senteza resolvins û proteînan, ku dikarin infiltration leukocyte asteng bikin û hilberîna cytokine kêm bikin navbeynkar dikin [248].
Neurosteroids, tevî pregnenolone û metabolîta wê ya jêrîn alopregnanolone, dibe ku di hin nexweşiyên derûnî de xwedî rolek bikêr be [248,260]. Di MDD de, gelek lêkolînan kêmbûna asta allopregnanolone ya plazma / CSF dît ku bi giraniya nîşanan re têkildar e, ku piştî dermankirina serketî bi hin antîdepresan re (mînak, SSRIs), û terapiya elektrokonvulsive [261] normal bû. Di şîzofreniyê de, asta pregnenolone ya mêjî dikare were guheztin [248] û asta allopregnanolone ya serumê dibe ku piştî hin dermanên antîpsîkotîkî (mînak, clozapine û olanzapine) zêde bibe [260]. Di sê ceribandinên randomkirî-kontrolkirî de (100 şîzofreniya (hevbendî); dirêjahiya dermankirinê, bi qasî neh hefte) nîşanên erênî, neyînî, û naskirî, û hem jî bandorên alîgirê ekstrapîramîdal ên antîpsîkotîkan di ceribandinek an çend ceribandinan de di nav wan kesên ku bi rasthatinî hatine veqetandin bi girîngî çêtir bûne. pregnenolone bi kesên ku placebo werdigirin re têkildar e [248]. Di ceribandinek de, çêtirbûn bi dermankirina pregnenolone-ya dirêj-dirêj [248] dom kir. Pregnenolone dikare bi xurtkirina fonksiyona receptorên NMDA û GABAA ve têgihîştin û tevgerê rêve bike [248]. Wekî din, allopregnanolone dikare bandorên neuroprotektîv û dijî-înflamatuar bike [248]. Zêdetir lêkolînên RCT hewce ne ku rola bikêr a steroîdên neuroaktîf di nexweşiyên psîkiyatrîkî yên destpêkê de di mirovan de piştrast bikin.
Em li benda encamên gelek ceribandinên klînîkî yên domdar in ku lêkolînê li ser bandorên dermankirinê yên dermanên din ên dij-înflamatuar dikin, di nav de salicylate, astengkerek NF-?B (NCT01182727); acetylsalicylic acid (NCT01320982); pravastatin (NCT1082588); û dextromethorphan, antagonîstek NMDAR-ê ne-hevrikî ye ku dikare birîna neuronal a dopamînergîkî ya ku ji iltîhaba hatî çêkirin sînordar bike (NCT01189006).
Stratejiyên Dermankirina Pêşerojê
Her çend tedawiyên xweparastinê yên heyî (mînakî, IVIG, plasmapheresis, kortikosteroîd û ajanên immunosuppressive) bi gelemperî ji bo dermankirina encephalîtîdên otoîmmune yên ku iltîhaba akût, tund û bi giranî bi eslê xwe adapteyî ye, bandorker in, bandora wan di nexweşiyên derûnî yên klasîk de ku iltîhaba kronîk e, heye.pir nermtir, û bi giranî bi eslê xwezayê ve, sînorkirî ye [2]. Pêşkeftina dermankirina nû divê armanc bike ku windabûna glial [46,138] paşde bixe, MAP-a zirardar bi rêkûpêk bike, di heman demê de T regezên neuroprotektîf ên endojen û MAP-a sûdmend xweşbîn bike, li şûna ku bêserûber tepisandina iltîhaba wekî ku bi ajanên immunosuppressive heyî pêk tê. Wekî din, pêşkeftina antîoksîdanên hev-adjuvant ên hêzdar ên ku di nexweşiyên derûnî de zirara oksîdative berovajî bikin hewce ye.
encamên
Xweserî dikare bibe sedema komek nexweşiyên neuropsîkiyatrîkî ku di destpêkê de dibe ku bi nîşanên derûnî yên veqetandî re diyar bibin. Iltîhaba/xweserûberiya xwedayî dibe ku bi pathogenesis nîşanên derûnî yên di binkomek nexweşên bi nexweşiyên derûnî yên klasîk re têkildar be. Dibe ku iltîhaba zikmakî bi mekanîzmakî bi anormaliyên monoaminergîk û glutamatergîk ên kevneşopî ve were girêdan û birînên oksîdatîf ên ku di nexweşiyên derûnî de hatine ragihandin zêde bibin.
Souhel Najjar1,5*, Daniel M Pearlman2,5, Kenneth Alper4, Amanda Najjar3 û Orrin Devinsky1,4,5
abbreviations
3-OH-KYN: 3-hîdroksî-kynurenîn; ?7nAchR: Alpha 7 nîkotînî receptorên acetylcholine; AMPAR: Receptorên Amino-3-hydroxy-5-methyl-l-4-isoxazolepropionic acid; APC: Antîgen şaneya pêşkêşker; BBB: Astengiya xwînê-mêjî;
BH4: Tetrahydrobiopterin; BPD: Nexweşiya bipolar; CI: Navbera pêbaweriyê;
CNS: Sîstema demarî ya navendî; COX-2: Cyclooxegenase-2; CSF: Ava cerebrospinal; DSM-IV: Destûra Diagnostîk û Îstatîstîkî ya Nexweşiyên Derûnî 4. Çapa; EAATs: Veguhezkerên asîda amînî yên dilşewat; eNOS: Endothelial nitric oxide synthase; GABAB: Gamma aminobutyric acid-beta; GAD: Glutamic acid decarboxylase; GFAP: Proteîna asîdî ya fibrillary glial; GLX: 1H MRS glutamate, glutamine, gamma aminobutyric acid pêkhatî;
IDO: Indoleamine 2,3-dioxygenase; Ig: Immunoglobulin; IL: Interleukin; IL-1RA: Antagonîstê receptorê Interleukin 1; IFN-?: Interferon gama;
KAT: Kynurenine aminotransferase; KMO: Kynurenine 3-monooxygenase; KYN: Kynurenine; KYNA: Asîdê Kynurenic; LE: Encefalît limbîk;
LPS: Lipopolysaccharide; MAP: Çalakkirin û belavbûna mîkroglial;
MDD: Nexweşiya depresyonê ya mezin; mGluR: Receptora glutamate ya metabotropîk; MHC: II kompleksa histokompatîbilîteya mezin çîna du; MRI: Wêneya rezonansê ya magnetîkî; MRS: Spektroskopiya rezonansa magnetîkî; NF-?B: Faktora nukleerê kappa B; NMDAR: N-methyl-D-aspartate receptor; NR1: Malpera Glycine;
OCD: Nexweşiya obsessive-mecbûrî; OR: Rêjeya astengiyan; PANDAS: Nexweşiyên xweser ên neuropsîkiyatrîkî yên zarokan ên ku bi enfeksiyonên streptococcal re têkildar in; PBMC: Xaneyên mononukleer ên xwînê yên derdor; PET: Tomografya belavkirina pozitronê; PFC: Korteksa pêşîn; PGE-2: Prostaglandin E2; PPAR-
?: gama receptora navokî ya ku bi proliferatorê peroksîzomê ve çalakkirî ye; QA: Kînolînik acid; RNS: Cureyên nîtrojenê yên reaktîf; ROS: Cureyên oksîjenê yên reaktîf;
sIL: Interleukin çareserker; SLE: Lupus erythematosus pergalî; SRI: Serotonin reuptake inhibitor; TNF-?: Faktora nekroza tumor alpha; T-regs: CD4 + CD25 + FOXP3 + T hucreyên birêkûpêk; TDO: Tryptophan-2,3-dioxygenase; Th: T-alîkar; VGKC: Kanala potasyûmê ya voltajê; XAG-: Veguhezkarê aspartate glutamate; Xc-: Astroglial glutamate/cystine serbixwe-natrium
sîstema antiporter
Interests Competitions
Nivîskaran ragihand ku ew neyek berjewendiyên me hene.
Nivîskar��Beşdariyên
SN û DMP lêkolînek edebî ya berfireh kirin, dane şîrove kirin, destnivîs, jimar û tablo amade kirin. KA beşa ku bi mekanîzmayên oksîdasyonê ve girêdayî ye amade kir û beşdarî guhertoyên destnivîsê bû. AN û OD sêwiran û qalîteya destnivîsê bi rexneyî-veguhertin û çêtir kirin. Hemû nivîskaran destnivîsa dawî xwend û pejirand.
Spasî
Em bi sipasiya Dr. Josep Dalmau, MD, PhD, Tracy Butler, MD, û David Zazag, MD, PhD, ji bo ku pisporiya xwe di encephalîtîdên otoîmmune, wênekêşiya neuroinflammasyonê, û neuropatolojiyê de peyda dikin.
Nivîskar� Detayên
1 Beşa Neurolojiyê, Dibistana Dermanê ya Zanîngeha New York, 550 First Avenue, New York, NY 10016, USA. 2 Dibistana Dermanê Geisel li Dartmouth, Enstîtuya Dartmouth ji bo Siyaseta Tenduristî û Pratîka Klînîkî, 30 Lafayette Street, HB 7252, Libnan, NH 03766, DY. 3Beşa Patholojiyê, Dabeşa Neuropatolojiyê, Dibistana Derman a Zanîngeha New York, 550 First Avenue, New York, NY 10016, USA. 4Beşa Psîkiyatriyê, Dibistana Bijîjkî ya Zanîngeha New York, New York, NY, USA. 5 Navenda Berfirehiya Epilepsiyê ya Zanîngeha New York, 550 First Avenue, New York, NY 10016, USA.
Vala
Çavkanî:
1. Kayser MS, Dalmau J: Têkiliya derketî di navbera nexweşiyên otoîmmune de
û nexweşiya neuropsîkiyatrîk. J Neuropsychiatry Clin Neurosci 2011, 23:90-97.
2. Najjar S, Pearlman D, Zagzag D, Golfinos J, Devinsky O: Glutamic acid
sendroma otoantîpodî ya decarboxylase ku wekî şîzofreniyê tê xuyang kirin.
Neurologist 2012, 18:88-91.
3. Graus F, Saiz A, Dalmau J: Antibodies û neuronên xweser
nexweşiyên CNS. J Neurol 2010, 257:509~517.
4. Lennox BR, Coles AJ, Vincent A: Encefalîtê bi navbeynkar antî laş: a
sedema dermankirina şîzofreniyê. Br J Psychiatry 2012, 200:92-94.
5. Zandi MS, Irani SR, Lang B, Waters P, Jones PB, McKenna P, Coles AJ, Vincent
A, Lennox BR: Di beşa yekem de otoantîbodeyên têkildar ên nexweşiyê
şîzofreniya. J Neurol 2011, 258:686~688.
6. Bataller L, Kleopa KA, Wu GF, Rossi JE, Rosenfeld MR, Dalmau J:
Di 39 nexweşan de encefalît limbîk otoîmmune: immunophenotip û
encamên. J Neurol Neurosurg Psychiatry 2007, 78:381�385.
7. Dale RC, Heyman I, Giovannoni G, Dêra AW: Bûyera dijî-mêjî
antîbodî di zarokên bi nexweşiya obsessive-mecbûrî de. Br J Psychiatry
2005, 187:314-319.
8. Kendler KS: Xwezaya nebaş a sedemên nexweşiya derûnî: li şûna
dubendiya organîk-fonksîyonel/hardware-nermalava bi ezmûnî
pirdengîtiya bingehîn. Mol Psychiatry 2012, 17:377�388.
9. Keskin G, Sunter G, Midi I, Tuncer N: Neurosyphilis wekî sedemek cognitive
kêmbûn û nîşanên derûnî di temenê biçûk de. J Neuropsychiatry Clin
Neurosci 2011, 23:E41�E42.
10. Leboyer M, Soreca I, Scott J, Frye M, Henry C, Tamouza R, Kupfer DJ: Can
nexweşiya bipolar wekî nexweşiyek înflamatuar a pir-pergalî were dîtin?
J Affect Disord 2012, 141:1:10.
11. Hackett ML, Yapa C, Parag V, Anderson CS: Frequency depresyonê piştî
stroke: lêkolînek sîstematîkî ya lêkolînên çavdêriyê. Stroke 2005, 36:1330~1340.
12. Dantzer R, O'Connor JC, Freund GG, Johnson RW, Kelley KW: Ji
iltîhaba nexweşî û depresyonê: dema ku pergala berevaniyê
mejî bindest dike. Nat Rev Neurosci 2008, 9:46�56.
13. Laske C, Zank M, Klein R, Stransky E, Batra A, Buchkremer G, Schott K:
Di seruma nexweşên bi depresyona mezin de reaktîvîteya otoantîbody,
şîzofreniya û kontrolên saxlem. Psychiatry Res 2008, 158:83~86.
14. Eisenberger NI, Berkman ET, Inagaki TK, Rameson LT, Mashal NM, Irwin MR:
Anhedonia ku ji ber iltîhaba çêdibe: endotoksîn striatumê ventral kêm dike
bersivên xelatê. Biol Psychiatry 2010, 68:748~754.
15. Haroon E, Raison CL, Miller AH: Psychoneuroimmunology hevdîtin dike
neuropsychopharmacology: encamên wergerê yên bandora
iltîhaba li ser tevgerê. Neuropsychopharmacology 2012, 37:137-162.
16. Benros ME, Nielsen PR, Nordentoft M, Eaton WW, Dalton SO, Mortensen PB:
Nexweşiyên otoîmmune û enfeksiyonên giran wekî faktorên xetereyê ne
şîzofreniya: lêkolînek qeyda nifûsê ya 30-salî. Am J Psychiatry
2011, 168:1303-1310.
17. McNally L, Bhagwagar Z, Hannestad J: Inflammation, glutamate, û glia
di depresyonê de: lêkolînek edebî. CNS Spectr 2008, 13:501~510.
18. Harrison NA, Brydon L, Walker C, Grey MA, Steptoe A, Critchley HD:
Iltîhab bi guhertinên di binjenê de dibe sedema guheztina moodê
çalakiya cingulate û girêdana mesolimbic. Biol Psychiatry 2009,
66:407~414.19. Raison CL, Miller AH: Ma depresyon nexweşiyek înflamatuar e?
Curr Psychiatry Rep 2011, 13:467~475.
20. Raison CL, Miller AH: Girîngiya pêşveçûnê ya depresyonê di
Parastina Host Pathogen (PATHOS-D). Mol Psychiatry 2013, 18:15º37.
21. Steiner J, Bogerts B, Sarnyai Z, Walter M, Gos T, Bernstein HG, Myint AM:
Pira valahiya di navbera hîpotezên xweparastinê û glutamate yên
şîzofreniya û depresyona mezin: Rola potansiyel a NMDA ya glial
modulatorên receptor û têkçûna yekbûna astengiya xwînê-mêjî. Cîhan J
Biol Psychiatry 2012, 13:482~492.
22. Steiner J, Mawrin C, Ziegeler A, Bielau H, Ullrich O, Bernstein HG, Bogerts B:
Belavbûna mîkroglia HLA-DR-erênî di şîzofreniyê de nîşan dide
lateralization mejî astengdar. Acta Neuropathol 2006, 112:305-316.
23. Papakostas GI, Shelton RC, Kinrys G, Henry ME, Bakow BR, Lipkin SH, Pi B,
Thurmond L, Bilello JA: Nirxandina pir-assay, serum-based
testa teşhîsa biyolojîkî ji bo nexweşiya depresyonê ya mezin: pîlotek û
lêkolîna dubarekirinê. Mol Psychiatry 2013, 18:332�339.
24. Krishnan R: Depresyona yekpolar di mezinan de: epidemiology, pathogenesis, û
neurobiology. Di UpToDate de. Ji hêla Basow DS ve hatî çap kirin. Waltham, MA: UpToDate; 2013.
25. Stovall J: Nexweşiya bipolar di mezinan de: epîdemîolojî û teşhîs. Li
Biroj. Ji hêla Basow DS ve hatî çap kirin. UpToDate: Waltham; 2013.
26. Fischer BA, Buchanan RW: Şîzofrenî: epîdemîolojî û pathogenesis.
Di UpToDate de. Ji hêla Basow DS ve hatî çap kirin. Waltham, MA: UpToDate; 2013.
27. Nestadt G, Samuels J, Riddle M, Bienvenu OJ 3rd, Liang KY, LaBuda M,
Walkup J, Grados M, Hoehn-Saric R: Lêkolînek malbatî ya obsessivecompulsive
bêsazî. Arch Gen Psychiatry 2000, 57:358�363.
28. Stefansson H, Ophoff RA, Steinberg S, Andreassen OA, Cichon S, Rujescu D,
Werge T, Pietilainen OP, Mors O, Mortensen PB, Sigurdsson E, Gustafsson O,
Nyegaard M, Tuulio-Henriksson A, Ingason A, Hansen T, Suvisaari J,
Lonnqvist J, Paunio T, Bârglum AD, Hartmann A, Fink-Jensen A, Nordentoft
M, Hougaard D, Norgaard-Pedersen B, Bâttcher Y, Olesen J, Breuer R, Müller
HJ, Giegling I, et al: Guhertoyên hevpar ên ku xetera şîzofreniyê vedigirin.
Xweza 2009, 460:744~747.
29. Môller N, Schwarz MJ: Guherîna navbeynkariya parastinê ya serotonin û
glutamate: ber bi nêrînek yekbûyî ya depresyonê. Mol Psychiatry
2007, 12:988-1000.
30. Galecki P, Florkowski A, Bienkiewics M, Szemraj J: Polymorfîzma fonksiyonel
Gena cyclooxygenase-2 (G-765C) di nexweşên depresyonê de.
Neuropsychobiology 2010, 62:116-120.
31. Levinson DF: Genetîka depresyonê: vekolînek. Biol Psychiatry 2006,
60: 84 92.
32. Zhai J, Cheng L, Dong J, Shen Q, Zhang Q, Chen M, Gao L, Chen X, Wang K,
Deng X, Xu Z, Ji F, Liu C, Li J, Dong Q, Chen C: S100B gen
polîmorfîzm di her du şîzofreniyê de fonksiyona mekanê ya pêşberî pêşbînî dikin
nexweş û kesên saxlem. Schizophr Res 2012, 134:89-94.
33. Zhai J, Zhang Q, Cheng L, Chen M, Wang K, Liu Y, Deng X, Chen X, Shen Q,
Xu Z, Ji F, Liu C, Dong Q, Chen C, Li J: Guhertoyên xetereyê di gena S100B de,
bi bilindbûna astên S100B re têkildar in, di heman demê de jî têkildar in
seqetiya visuospatial ya şîzofreniyê. Behav Brain Res 2011, 217:363�368.
34. Cappi C, Muniz RK, Sampaio AS, Cordeiro Q, Brentani H, Palacios SA,
Marques AH, Vallada H, Miguel EC, Guilherme L, Hounie AG: Komele
lêkolîna di navbera polîmorfîzmên fonksiyonel ên di gena TNF-alpha de û
nexweşiya obsessive-mecbûrî. Arq Neuropsiquiatr 2012, 70:87.
35. Miguel-Hidalgo JJ, Baucom C, Dilley G, Overholser JC, Meltzer HY,
Stockmeier CA, Rajkowska G: Proteîna asîdî ya fibrillary glial
immunoreactivity di kortika pêşgotinê de ciwantir ji hev cuda dike
mezinên pîr di nexweşiya depresyonê ya mezin de. Biol Psychiatry 2000, 48:861~873.
36. Altshuler LL, Abulseoud OA, Foland Ross L, Bartzokis G, Chang S, Mintz J,
Hellemann G, Vinters HV: Kêmkirina astrocyte Amygdala di mijarên bi
nexweşiya depresyonê ya mezin lê ne nexweşiya bipolar. Nexweşiya Bipolar 2010,
12: 541 549.
37. Webster MJ, Knable MB, Johnston-Wilson N, Nagata K, Inagaki M, Yolken RH:
Herêmîbûna immunohistokîmyayî ya asîda fîbrillary glial fosforylated
proteîna di kortikê pêşîn û hîpokampusê de ji nexweşên bi
şîzofreniya, nexweşiya bipolar, û depresyonê. Brain Behav Immun 2001,
15: 388 400.
38. Doyle C, Deakin JFW: Kêmtir astrocytes di kortika pêşiyê de di şîzofreniyê de,
depresyon û nexweşiya bipolar. Schizophrenia Res 2002, 53:106.
39. Johnston-Wilson NL, Sims CD, Hofmann JP, Anderson L, Shore AD, Torrey
EF, Yolken RH: Guhertinên taybetî yên nexweşiyê di proteînên mêjî yên korteksa pêşiyê de
di şîzofreniya, nexweşiya bipolar, û nexweşiya depresyonê ya mezin de, The
Konsorsiyuma Neuropatolojiya Stanley. Mol Psychiatry 2000, 5:142~149.
40. Gosselin RD, Gibney S, O'Malley D, Dinan TG, Cryan JF: Herêma taybet
kêmbûna immunoreactivity proteîna asîdî fibrillary glial di mêjiyê de
modela rat depresyonê. Neuroscience 2009, 159:915-925.
41. Banasr M, Duman RS: Wendabûna glial di kortika pêşberî de bes e ku
tevgerên mîna depresyonê derdixin. Biol Psychiatry 2008, 64:863~870.
42. Cotter D, Hudson L, Landau S: Delîl ji bo patholojiya orbitofrontal di
nexweşiya bipolar û depresyona mezin, lê ne di şîzofreniyê de.
Nerazîbûna Bipolar 2005, 7:358�369.
43. Brauch RA, Adnan El-Masri M, Parker J Jr, El-Mallahh RS: Hejmara şaneya glial
û rêjeyên hucreya neuron / glial di mejiyên postmortem ên mirovên bipolar de.
J Affect Disord 2006, 91:87:90.
44. Cotter DR, Pariante CM, Everall IP: Nexweşiyên hucreya glial di mezin de
Nexweşiyên derûnî: delîl û encamên. Brain Res Bull 2001,
55: 585 595.
45. Cotter D, Mackay D, Landau S, Kerwin R, Everall I: Tîrêjiya hucreya glial kêm kirin
û mezinahiya neuronal di korteksa cingulate ya pêş de di depresyonek mezin de
bêsazî. Arch Gen Psychiatry 2001, 58:545�553.
46. Bowley MP, Drevets WC, Ong�r D, Price JL: Hejmarên glial yên kêm di
amygdala di nexweşiya depresyonê ya mezin de. Biol Psychiatry 2002, 52:404~412.
47. Toro CT, Hallak JE, Dunham JS, Deakin JF: Proteîna asîdî ya fibrillary glial û
glutamine synthetase li jêr-herêmên korteksa pêşbirkê di şîzofreniyê de
û nexweşiya moodê. Neurosci Lett 2006, 404:276-281.
48. Rajkowska G, Miguel-Hidalgo JJ, Makkos Z, Meltzer H, Overholser J,
Stockmeier C: Kêmkirina qat-taybetî di astroglia-reaktîf a GFAP de
Di şîzofreniyê de kortika pêşgotina dorsolateral. Schizophr Res 2002, 57:127-138.
49. Steffek AE, McCullumsmith RE, Haroutunian V, Meador-Woodruff JH: Cortical
îfadeya proteîna asîdî ya fibrillary glial û glutamine synthetase ye
di şîzofreniyê de kêm bûye. Schizophr Res 2008, 103:71~82.
50. Damadzic R, Bigelow LB, Krimer LS, Goldenson DA, Saunders RC, Kleinman
JE, Herman MM: Lêkolînek immunohistokîmyayî ya hejmarî ya astrocytes li
korteksa entorhînal di şîzofreniyê, nexweşiya bipolar û mezin de
depresyon: nebûna astrocytosis girîng. Brain Res Bull 2001, 55:611~618.
51. Benes FM, McSparren J, Bird ED, SanGiovanni JP, Vincent SL: Kêmasiyên di
interneuronên piçûk ên di kortikên şizofrenîk ên pêşfrontal û cingulate de
û nexweşên şîzoaffektîf. Arch Gen Psychiatry 1991, 48:996-1001.
52. Môller N, Schwarz MJ: Pergala parastinê û şîzofreniya. Curr Immunol
Rev 2010, 6:213-220.
53. Steiner J, Walter M, Gos T, Guillemin GJ, Bernstein HG, Sarnyai Z, Mawrin C,
Brisch R, Bielau H, Meyer Zu Schwabedissen L, Bogerts B, Myint AM: Severe
depresyon bi zêdebûna asîda quinolinic mîkroglial ve girêdayî ye
jêrherêmên gyrusa cingulate ya pêşîn: delîl ji bo immunemodulated
neurotransmission glutamatergîk? J Neuroinflammation 2011, 8:94.
54. Vostrikov VM, Uranova NA, Orlovskaya DD: Kêmasiya perineuronal
oligodendrocytes di kortikê pêşîn de di şîzofreniyê û moodê de
nexweşiyên. Schizophr Res 2007, 94:273-280.
55. Rajkowska G, Miguel-Hidalgo JJ: Gliogenesis û patholojiya glial di
hişleqî. CNS Neurol Disord Drug Targets 2007, 6:219-233.
56. Uranova NA, Vostrikov VM, Orlovskaya DD, Rachmanova VI:
Di şîzofreniyê de dendika oligodendroglial di kortika pêşgotinê de û
Nexweşiyên moodê: lêkolînek ji Konsorsiyuma Neuropatolojiya Stanley.
Schizophr Res 2004, 67:269�275.
57. Uranova N: Zirar û windakirina oligodendrocytes di
pathogenesis şîzofreniyê û nexweşiyên moodê (vedîtinan pêk tê
lêkolînên piştî mirinê). Neuropsychopharmacology 2004, 29: S33.
58. Uranova NA, Orlovskaya DD, Vostrikov VM, Rachmanova VI: Kêm kirin
tîrbûna satelaytên oligodendroglial yên noyronên pîramîdal di qata III de
di şîzofreniyê û nexweşiyên moodê de kortika pêşgotinê. Schizophr Res
2002, 53:107.
59. Vostrikov VM, Uranova NA, Rakhmanova VI, Orlovskaia DD: Lowered
Di şîzofreniyê de di korteksa pêşrûnî de tîrêjiya hucreya oligodendroglial.
Zh Nevrol Psikhiatr Im SS Korsakova 2004, 104:47�51.
60. Uranova NA, Zimina IS, Vikhreva OV, Krukov NO, Rachmanova VI, Orlovskaya
DD: Zerara ultrastruktural a kapilaran di neokortex de
şîzofreniya. World J Biol Psychiatry 2010, 11:567~578.
61. Hof PR, Haroutunian V, Friedrich VL Jr, Byne W, Buitron C, Perl DP, Davis KL:
Wendabûn û guheztina belavkirina cîhê ya oligodendrocytes di jorîn de
gyrus eniya di şîzofreniyê de. Biol Psychiatry 2003, 53:1075-1085.
62. Davis KL, Stewart DG, Friedman JI, Buchsbaum M, Harvey PD, Hof PR,
Buxbaum J, Haroutunian V: Guhertinên madeya spî di şîzofreniyê de:
delîlên ji bo xerabûna têkildarî myelin. Arch Gen Psychiatry 2003,
60:443~456.63. Flynn SW, Lang DJ, Mackay AL, Goghari V, Vavasour IM, Whittall KP, Smith
GN, Arango V, Mann JJ, Dwork AJ, Falkai P, Honer WG: Nexweşiyên
myelination di şîzofreniyê de di vivo de bi MRI, û postmortem ve hatî tespît kirin
bi analîzkirina proteînên oligodendrocyte. Mol Psychiatry 2003,
8: 811 820.
64. Uranova NA, Vostrikov VM, Vikhreva OV, Zimina IS, Kolomeets NS, Orlovskaya
DD: Rola patholojiya oligodendrocyte di şîzofreniyê de. Int J
Neuropsychopharmacol 2007, 10:537~545.
65. Byne W, Kidkardnee S, Tatusov A, Yiannoulos G, Buchsbaum MS,
Haroutunian V: Kêmkirina bi şîzofreniyê ya neuronal û
hejmarên oligodendrocyte di navokê talamîk ya sereke ya pêşîn de.
Schizophr Res 2006, 85:245�253.
66. Hamidi M, Drevets WC, Price JL: Kêmkirina glial di amygdala de di mezin de
nexweşiya depresîv ji ber oligodendrocytes e. Biol Psychiatry 2004,
55: 563 569.
67. Bayer TA, Buslei R, Havas L, Falkai P: Delîlên ji bo aktîvkirina mîkroglia di
nexweşên bi nexweşiyên derûnî. Neurosci Lett 1999, 271:126-128.
68. Steiner J, Bielau H, Brisch R, Danos P, Ullrich O, Mawrin C, Bernstein HG,
Bogerts B: Di neurobiolojiya xwekujiyê de aliyên immunolojîkî:
di şîzofreniyê û depresyonê de tansiyona mîkroglial zêde ye
bi xwekujiyê ve girêdayî ye. J Psychiatr Res 2008, 42:151~157.
69. Rao JS, Harry GJ, Rapoport SI, Kim HW: Zêdebûna excitotoxicity û
nîşankerên neuroînflamatuar ên di kortika pêşiyê ya piştî mirinê de ji bipolar
nexweşên nexweşiyê. Mol Psychiatry 2010, 15:384�392.
70. Bernstein HG, Steiner J, Bogerts B: Di şîzofreniyê de şaneyên glial:
girîngiya patofîzyolojîk û encamên gengaz ên ji bo dermankirinê.
Pispor Rev Neurother 2009, 9:1059�1071.
71. Chen SK, Tvrdik P, Peden E, Cho S, Wu S, Spangrude G, Capecchi MR:
Eslê hematopoietîkî ya paqijkirina patholojîk di mişkên mutant Hoxb8 de.
Cell 2010, 141:775~785.
72. Antony JM: Çêkirin û mezinbûna bi mîkroglia. Sci Signal 2010, 3: jc8.
73. Wonodi I, Stine OC, Sathyasaikumar KV, Roberts RC, Mitchell BD, Hong LE,
Kajii Y, Thaker GK, Schwarcz R: Kynurenine daxistî 3-
Di şîzofreniyê de îfadeya gena monooxygenase û çalakiya enzîmê
û têkiliya genetîkî bi endophenotipên şîzofreniyê re. Arch Gen
Psychiatry 2011, 68:665~674.
74. Raison CL, Lowry CA, Rook GA: Inflammation, paqijî, û
matmayîn: windabûna têkiliya bi hevçeperan re, tolerogenîk
mîkroorganîzma û pathofyzyolojî û dermankirina sereke
hişleqî. Arch Gen Psychiatry 2010, 67:1211~1224.
75. Drexhage RC, Hoogenboezem TH, Versnel MA, Berghout A, Nolen WA,
Drexhage HA: Di nexweşan de aktîvkirina torên monosît û hucreyên T
bi nexweşiya bipolar. Brain Behav Immun 2011, 25:1206~1213.
76. Steiner J, Jacobs R, Panteli B, Brauner M, Schiltz K, Bahn S, Herberth M,
Westphal S, Gos T, Walter M, Bernstein HG, Myint AM, Bogerts B: Acute
Şîzofreniya bi kêmbûna şaneya T û zêdekirina şaneya B re tê
zixtî. Eur Arch Psychiatry Clin Neurosci 2010, 260:509�518.
77. Rotge JY, Aouizerate B, Tignol J, Bioulac B, Burbaud P, Guehl D: The
Hîpoteza xweparastinê ya genetîkî ya li ser bingeha glutamate di obsessive-mecbûrî de
nexweşî, Nêzîkatiyek entegreyî ji genan heya nîşanan.
Neuroscience 2010, 165:408~417.
78. Y'ksel C, Ong�r D: Vekolînên spektroskopiya rezonansa magnetîkî ya
di nexweşiyên moodê de anormaliyên bi glutamate ve girêdayî ne. Biol Psychiatry 2010,
68: 785 794.
79. Rao JS, Kellom M, Reese EA, Rapoport SI, Kim HW: Glutamate nerêkûpêk
û veguhezkerên dopamînê di kortika pêşiyê ya paşverû de ji bipolar
û nexweşên şîzofrenîk. J Affect Disord 2012, 136:63-71.
80. Bauer D, Gupta D, Harotunian V, Meador-Woodruff JH, McCullumsmith RE:
Ragihandina anormal a veguhezkar û veguhezkarê glutamate
di nexweşên kal û pîr de bi molekulên ku di korteksa pêşgotinê de tevdigerin
şîzofreniya. Schizophr Res 2008, 104:108-120.
81. Matute C, Melone M, Vallejo-Illarramendi A, Conti F: Zêdebûna îfadeyê
ya veguhezkarê glûtamatê astrosîtîk GLT-1 di kortika pêşberî ya
şîzofrenîk. 2005, 49:451~455.
82. Smith RE, Haroutunian V, Davis KL, Meador-Woodruff JH: Expression of
di talamusa mijaran de transkrîptên veguhezkarê asîda amînî ya dilşewat
bi şîzofreniyê. Am J Psychiatry 2001, 158:1393-1399.
83. McCullumsmith RE, Meador-Woodruff JH: Amîno asîdê dilşikestî yê Striatal
di şîzofreniya, nexweşiya bipolar de îfadeya transkripta veguhêzkar,
û nexweşiya depresyonê ya mezin. Neuropsychopharmacology 2002,
26: 368 375.
84. Pittenger C, Bloch MH, Williams K: Nexweşiyên glutamate yên di nav çavan de
Nexweşiya mecbûrî: neurobiolojî, patofîzyolojî, û dermankirin.
Pharmacol Ther 2011, 132:314-332.
85. Hashimoto K: Di patofîzyolojiya glutamate de rola pêşkeftî
nexweşiya depresyonê ya mezin. Brain Res Rev 2009, 61:105�123.
86. Hashimoto K, Sawa A, Iyo M: Zêdebûna asta glutamate di mêjî de ji
nexweşên bi nexweşiyên mood. Biol Psychiatry 2007, 62:1310~1316.
87. Burbaeva G, Boksha IS, Turishcheva MS, Vorobyeva EA, Savushkina OK,
Tereshkina EB: Glutamine synthetase û glutamate dehydrogenase tê de
kortika pêşberî ya nexweşên bi şîzofreniyê. Prog
Neuropsychopharmacol Biol Psychiatry 2003, 27:675-680.
88. Bhattacharyya S, Khanna S, Chakrabarty K, Mahadevan A, Christopher R,
Shankar SK: Otoantîbodeyên dijî-mêjî û guheztina guheztinê
neurotransmitters di nexweşiya obsessive-mecbûrî de.
Neuropsychopharmacology 2009, 34:2489-2496.
89. Sanacora G, Gueorguieva R, Epperson CN, Wu YT, Appel M, Rothman DL,
Krystal JH, Mason GF: Guherandinên jêrîn-taybetî yên gammaaminobutyric
di nexweşên bi depresyona mezin de asîd û glutamate.
Arch Gen Psychiatry 2004, 61:705-713.
90. Marsman A, van den Heuvel MP, Klomp DW, Kahn RS, Luijten PR, Hulshoff
Pol HE: Glutamate di şîzofreniyê de: vekolînek berbiçav û meta-analîz
lêkolînên 1H-MRS. Schizophr Bull 2013, 39:120~129.
91. Liu Y, Ho RC, Mak A: Interleukin (IL)-6, faktora nekroza tumor alpha
(TNF-alpha) û receptorên înterleukîn-2 yên çareserbûyî (sIL-2R) di nav de zêde dibin.
nexweşên bi nexweşiya depresyonê ya mezin: meta-analîz û metaregression.
J Affect Disord 2012, 139:230:239.
92. Brietzke E, Stabellini R, Grassis-Oliveira R, Lafer B: Cytokines in bipolar
nexweşî: dîtinên vê dawiyê, bandorên zirardar lê ji bo pêşerojê soz didin
terapeutîk. CNS Spectr 2011. www.cnsspectrums.com/aspx/
articledetail.aspx?articleid=3596.
93. Denys D, Fluitman S, Kavelaars A, Heijnen C, Westenberg H: Kêm kirin
Çalakiya TNF-alpha û NK di nexweşiya obsessive-mecbûrî de.
Psychoneuroendocrinology 2004, 29:945-952.
94. Brambilla F, Perna G, Bellodi L, Arancio C, Bertani A, Perini G, Carraro C, Gava
F: Di plazma interleukin-1 beta û giraniya faktora nekroza tumor de
nexweşiyên obsessive-mecbûrî. Biol Psychiatry 1997, 42:976-981.
95. Fluitman S, Denys D, Vulink N, Schutters S, Heijnen C, Westenberg H:
Di obsessivecompulsive de hilberîna cytokine-lipopolysaccharide-deduced
nexweşî û nexweşiya xemgîniya civakî ya gelemperî. Psychiatry
Res 2010, 178:313-316.
96. Janelidze S, Mattei D, Westrin A, Traskman-Bendz L, Brundin L: Cytokine
asta xwînê dikare hewlên xwekuştinê ji depresyonê cuda bike
nexweşan. Brain Behav Immun 2011, 25:335�339.
97. Postal M, Costallat LT, Appenzeller S: Nîşaneyên neuropsîkiyatrîkî di
lupus erythematosus pergalî: epidemiology, pathophysiology û
serekî. CNS Drugs 2011, 25:721-736.
98. Kozora E, Hanly JG, Lapteva L, Filley CM: Disfunctiona cognitive di
lupus erythematosus pergalî: paşeroj, niha û pêşeroj.
Arthritis Rheum 2008, 58:3286-3298.
99. Lancaster E, Martinez-Hernandez E, Dalmau J: Encephalitis û antibodies to
proteînên rûxara şaneya sinaptîk û neuronal. Neurolojî 2011, 77:179-189.
100. Dalmau J, Lancaster E, Martinez-Hernandez E, Rosenfeld MR, Balice-Gordon
R: Tecrûbeya klînîkî û lêkolînên laboratîf di nexweşên bi antiNMDAR de
encephalitis. Lancet Neurol 2011, 10:63~74.
101. Lai M, Huijbers MG, Lancaster E, Graus F, Bataller L, Balice-Gordon R, Cowell
JK, Dalmau J: Lêkolîna LGI1 wekî antigen di encephalitis limbic de
berê ji kanalên potasiyûmê re tê veqetandin: rêzeyek dozê. Lancet Neurol
2010, 9:776-785.
102. Lancaster E, Huijbers MG, Bar V, Boronat A, Wong A, Martinez-Hernandez E,
Wilson C, Jacobs D, Lai M, Walker RW, Graus F, Bataller L, Illa I, Markx S, Strauss
KA, Peles E, Scherer SS, Dalmau J: Vekolînên caspr2, otoantîjenek
encephalitis û neuromyotonia. Ann Neurol 2011, 69:303-311.
103. Lancaster E, Lai M, Peng X, Hughes E, Constantinescu R, Raizer J, Friedman
D, Skeen MB, Grisold W, Kimura A, Ohta K, Iizuka T, Guzman M, Graus F,
Moss SJ, Balice-Gordon R, Dalmau J: Antîkorên li hember receptora GABA (B) li
encephalitis lîmbîk bi destgirtinê: rêzikên bûyeran û taybetmendiya wê
antigen. Lancet Neurol 2010, 9:67~76.
104. Lancaster E, Martinez-Hernandez E, Titulaer MJ, Boulos M, Weaver S, Antoine
JC, Liebers E, Kornblum C, Bien CG, Honnorat J, Wong S, Xu J, Peymandar A,
Balice-Gordon R, Dalmau J: Antîbodî li hember glutamate metabotropîk
receptor 5 di sendroma Ophelia de. Neurolojî 2011, 77:1698-1701.105. Ances BM, Vitaliani R, Taylor RA, Liebeskind DS, Voloschin A, Houghton DJ,
Galetta SL, Dichter M, Alavi A, Rosenfeld MR, Dalmau J: Tedawiya Bersiv
encephalitis limbic ku ji hêla antîbodîyên neuropil ve têne nas kirin: MRI û
PET têkildar e. Mejî 2005, 128:1764-1777.
106. Tofaris GK, Irani SR, Cheeran BJ, Baker IW, Cader ZM, Vincent A:
Koreya bersivdar-îmmunoterapî wekî taybetmendiya pêşkêşkirina LGI1-
encephalitis antîbody. Neurolojî 2012, 79:195-196.
107. Najjar S, Pearlman D, Najjar A, Ghiasian V, Zagzag D, Devinsky O:
Encefalît otoîmmune Extralimbic ku bi glutamic acid ve girêdayî ye
Antîkorên dekarboksîlaz: hebûnek kêm-naskirî? Epilepsy Behav
2011, 21:306-313.
108. Titulaer MJ, McCracken L, Gabilondo I, Armangue T, Glaser C, Iizuka T, Honig
LS, Benseler SM, Kawachi I, Martinez-Hernandez E, Aguilar E, Gresa-Arribas N,
Ryan-Florance N, Torrents A, Saiz A, Rosenfeld MR, Balice-Gordon R, Graus F,
Dalmau J: Dermankirin û faktorên prognostîk ên ji bo encamên demdirêj di nav de
nexweşên bi encephalitis receptorên dijî-NMDA: hevrêzek çavdêriyê
xwendina zanko. Lancet Neurol 2013, 12:157~165.
109. Dalmau J, Gleichman AJ, Hughes EG, Rossi JE, Peng X, Lai M, Dessain SK,
Rosenfeld MR, Balice-Gordon R, Lynch DR: Anti-NMDA-receptor
encephalitis: rêzikên dozê û analîzkirina bandorên antîkoran.
Lancet Neurol 2008, 7:1091-1098.
110. Graus F, Boronat A, Xifro X, Boix M, Svigelj V, Garcia A, Palomino A, Sabater
L, Alberch J, Saiz A: Berfirehkirina profîla klînîkî ya receptora dijî-AMPA
encephalitis. Neurolojî 2010, 74:857~859.
111. Lai M, Hughes EG, Peng X, Zhou L, Gleichman AJ, Shu H, Mata S, Kremens
D, Vitaliani R, Geschwind MD, Bataller L, Kalb RG, Davis R, Graus F, Lynch DR,
Balice-Gordon R, Dalmau J: Antîkorên receptorê AMPA di lîmbîkê de
encephalitis cîhê receptorên synaptîk diguhezîne. Ann Neurol 2009, 65:424~434.
112. Najjar S, Pearlman D, Devinsky O, Najjar A, Nadkarni S, Butler T, Zagzag D:
Encefalît otoîmmune ya neuropsîkiyatrîk bi kompleksa VGKC ya neyînî,
NMDAR, û otoantîpoşên GAD: raporek dozê û vekolîna wêjeyê,
pêşeroj. Cogn Behav Neurol. di çapemeniyê de.
113. Najjar S, Pearlman D, Zagzag D, Devinsky O: Bi xweber çareserkirin
encefalît limbîk otoîmmune seronegatîv. Cogn Behav Neurol 2011,
24: 99 105.
114. Gabilondo I, Saiz A, Galan L, Gonzalez V, Jadraque R, Sabater L, Sans A,
Sempere A, Vela A, Villalobos F, Viñals M, Villoslada P, Graus F: Analysis of
di encephalitis antî-NMDAR de vegere. Neurolojî 2011, 77:996-999.
115. Barry H, Hardiman O, Healy DG, Keogan M, Moroney J, Molnar PP, Cotter
DR, Murphy KC: Encefalîtê receptorê dijî-NMDA: girîngiyek
teşhîsa cuda di psîkozê de. Br J Psychiatry 2011, 199:508~509.
116. Dickerson F, Stallings C, Vaughan C, Origoni A, Khushalani S, Yolken R:
Di mania de dijî receptora glutamate antîbodî. Nexweşiya Bipolar 2012,
14: 547 553.
117. O'Loughlin K, Ruge P, McCauley M: Encephalitis û schizophrenia: a
meseleya peyvan. Br J Psychiatry 2012, 201:74.
118. Parratt KL, Allan M, Lewis SJ, Dalmau J, Halmagyi GM, Spies JM: Acute
Nexweşiya derûnî di jinek ciwan de: rengek neasayî ya encephalitis.
Med J Aust 2009, 191:284�286.
119. Suzuki Y, Kurita T, Sakurai K, Takeda Y, Koyama T: Raporta doza dijî-NMDA
encephalitis receptor bi gumana şîzofreniyê. Seishin Shinkeigaku
Zasshi 2009, 111:1479~1484.
120. Tsutsui K, Kanbayashi T, Tanaka K, Boku S, Ito W, Tokunaga J, Mori A,
Hishikawa Y, Shimizu T, Nishino S: Dij-NMDA-receptor antîpoş hat tespîtkirin
di encefalît, şîzofreniya û narkolepsiya bi taybetmendiyên psîkotîk de.
BMC Psychiatry 2012, 12:37.
121. Van Putten WK, Hachimi-Idrissi S, Jansen A, Van Gorp V, Huyghens L:
Sedema nefermî ya tevgera psîkotîk di keçek 9-salî de: dozek
nûçe. Case Report Med 2012, 2012: 358520.
122. Masdeu JC, Gonzalez-Pinto A, Matute C, Ruiz De Azua S, Palomino A, De
Leon J, Berman KF, Dalmau J: Serum antîbodî IgG li dijî NR1
yekîneya receptorê NMDA di şîzofreniyê de nayê dîtin. Am J
Psychiatry 2012, 169:1120~1121.
123. Kirvan CA, Swedo SE, Kurahara D, Cunningham MW: Mimicry Streptococcal
û di pathogenesis de îşaretkirina hucreyê ya bi navbeynkariya antîpodî
koreya Sydenham. Xweserî 2006, 39:21:29.
124. Swedo SE: Enfeksiyona streptokokî, sendroma Tourette, û OCD: heye
girêdanek? Panda: Hesp an zebra? Neurolojî 2010, 74:1397-1398.
125. Morer A, Lazaro L, Sabater L, Massana J, Castro J, Graus F: Antineuronal
antîbodî di komek zarokên bi nexweşiya obsessive-mecbûrî de
û sendroma Tourette. J Psychiatr Res 2008, 42:64�68.
126. Pavone P, Bianchini R, Parano E, Incorpora G, Rizzo R, Mazzone L, Trifiletti RR:
Di PANDAS-ê de li hember streptokokên bêtevlî antîkorên dijî-mêjî
derbasî. Pediatr Neurol 2004, 30:107~110.
127. Maina G, Albert U, Bogetto F, Borghese C, Berro AC, Mutani R, Rossi F,
Vigliani MC: Di nexweşên mezinan de bi obsessivecompulsive antîbodên dijî-mêjî
bêsazî. J Affect Disord 2009, 116:192-200.
128. Brimberg L, Benhar I, Mascaro-Blanco A, Alvarez K, Lotan D, Zivistan C, Klein J,
Moses AE, Somnier FE, Leckman JF, Swedo SE, Cunningham MW, Joel D:
Nexweşiyên behreyî, dermankolojîk û immunolojîk piştî
Ragihandina streptokok: modelek mişkek nû ya koreya Sydenham û
nexweşiyên neuropsîkiyatrîkî yên têkildar. Neuropsychopharmacology 2012,
37: 2076 2087.
129. Dale RC, Candler PM, Church AJ, Wait R, Pocock JM, Giovannoni G:
Enzîmên glîkolîtîk ên rûxara neuronal hedefên otoantîjen in
nexweşiya CNS ya otoîmmune ya post-streptokok. J Neuroimmunol 2006,
172: 187 197.
130. Nicholson TR, Ferdinando S, Krishnaiah RB, Anhoury S, Lennox BR, MataixCols
D, Cleare A, Veale DM, Drummond LM, Fineberg NA, Church AJ,
Giovannoni G, Heyman I: Berbelavbûna antîkorên ganglia yên dijî-bazal li
Nexweşiya obsessive-mecbûrî ya mezinan: lêkolîna çargoşe. Br J Psychiatry
2012, 200:381-386.
131. Wu K, Hanna GL, Rosenberg DR, Arnold PD: Rola glutamate
di pathogenesis û dermankirina obsessive-mecbûrî de nîşan dide
bêsazî. Pharmacol Biochem Behav 2012, 100:726~735.
132. Perlmutter SJ, Leitman SF, Garvey MA, Hamburger S, Feldman E, Leonard
HL, Swedo SE: Veguheztina plazmaya dermankirî û hundurîn
immunoglobulin ji bo nexweşiya obsessive-mecbûrî û nexweşiyên tic di
zarotî. Lancet 1999, 354:1153-1158.
133. Pereira A Jr, Furlan FA: Astrocytes û zanîna mirovî: modelkirin
entegrasyona agahdariyê û modulasyona çalakiya neuronal.
Prog Neurobiol 2010, 92:405~420.
134. Barres BA: Sir û sêrbaziya glia: perspektîfek li ser rolên wan di
tenduristî û nexweşî. Neuron 2008, 60:430~440.
135. Verkhratsky A, Parpura V, Rodriguez JJ: Cihê ku raman lê dimînin:
fîzyolojiya neuronal-glial "tora neuralî ya belav". Brain Res Rev 2011,
66: 133 151.
136. Sofroniew MV: Dabeşkirina molekulî ya astrogliosis reaktîf û birîna glial
damezrandina. Trends Neurosci 2009, 32:638-647.
137. Hamilton NB, Attwell D: Ma astrocytes bi rastî neurotransmitter exocytose dikin?
Nat Rev Neurosci 2010, 11:227�238.
138. Rajkowska G: Lêkolînên piştî mirinê di nexweşiyên moodê de guheztin nîşan didin
hejmara neuron û şaneyên glial. Biol Psychiatry 2000, 48:766~777.
139. Coupland NJ, Ogilvie CJ, Hegadoren KM, Seres P, Hanstock CC, Allen PS:
Di nexweşiya depresyonê ya mezin de Myo-inositol prefrontal kêm dibe.
Biol Psychiatry 2005, 57:1526~1534.
140. Miguel-Hidalgo JJ, Overholser JC, Jurjus GJ, Meltzer HY, Dieter L, Konick L,
Stockmeier CA, Rajkowska G: Immunoreactivity vascular û extravascular
ji bo molekula adhesionê ya navxaneyî 1 di kortika orbitofrontal de ya
mijarên bi depresyona mezin: Guhertinên girêdayî temenê. J Disord bandor dike
2011, 132:422-431.
141. Miguel-Hidalgo JJ, Wei JR, Andrew M, Overholser JC, Jurjus G, Stockmeier
CA, Rajkowska G: Patolojiya Glia di kortikê pêşîn de di alkolê de
girêdayîbûna bi û bêyî nîşanên depresîv. Biol Psychiatry 2002,
52: 1121 1133.
142. Stockmeier CA, Mahajan GJ, Konick LC, Overholser JC, Jurjus GJ, Meltzer HY,
Uylings HB, Friedman L, Rajkowska G: Guhertinên hucreyî yên di piştî mirinê de
hîpokampus di depresyona mezin de. Biol Psychiatry 2004, 56:640~650.
143. Ongðr D, Drevets WC, Biha JL: Kêmkirina glial di pêşgotina binejenî de
cortex di nexweşiyên moodê de. Proc Natl Acad Sci USA 1998, 95:13290�13295.
144. Gittins RA, Harrison PJ: Lêkolînek morfometrikî ya glia û neuronan di
di nexweşiya moodê de kortika cingulate ya pêşiyê. J Affect Disord 2011,
133: 328 332.
145. Cotter D, Mackay D, Beasley C, Kerwin R, Everall I: Tîrêjiya glial kêm kirin
û hêjmara neuronal di nexweşiya depresîv a mezin û şîzofreniyê de
cortex singulate anterior [abstract]. Şîzofreniya Res 2000, 41:106.
146. Si X, Miguel-Hidalgo JJ, Rajkowska G: Gotina GFAP di nav de kêm dibe
dorsolateral prefrontal cortex di depresyonê de. Di Society for Neuroscience de; 2003.
Plana Hevdîtina Neuroscience: New Orleans; 2003.
147. Legutko B, Mahajan G, Stockmeier CA, Rajkowska G: Astrocytes madeya spî
di depresyonê de kêm dibin. Di Society for Neuroscience de. Civîna Neuroscience
Plansaz: Washington, DC; 2011.148. Edgar N, Sibille E: Ji bo oligodendrocytes rolek fonksiyonel a berbiçav
rêziknameya mood. Transl Psychiatry 2012, 2:e109.
149. Rajkowska G, Halaris A, Selemon LD: Kêmkirina di neuronal û glial de
density kortika pêşberî ya dorsolateral di bipolar de diyar dike
bêsazî. Biol Psychiatry 2001, 49:741~752.
150. Cotter D, Mackay D, Chana G, Beasley C, Landau S, Everall IP: Kêm kirin
mezinahiya neuronal û tîrbûna hucreya glial li devera 9 ya dorsolateral
di mijarên bi nexweşiya depresîv a mezin de korteksa pêşîn. Cereb Cortex
2002, 12:386-394.
151. Stark AK, Uylings HB, Sanz-Arigita E, Pakkenberg B: Wendabûna hucreya glial di nav de
cortex cingulate anterior, jêrherêma korteksa pêşrû, li
mijarên bi şîzofreniyê. Am J Psychiatry 2004, 161:882-888.
152. Konopaske GT, Dorph-Petersen KA, Sweet RA, Pierri JN, Zhang W, Sampson
AR, Lewis DA: Bandora rûxandina antîpsîkotîk a kronîk li ser astrocyte û
hejmara oligodendrocyte di meymûnên macaque de. Biol Psychiatry 2008,
63: 759 765.
153. Selemon LD, Lidow MS, Goldman-Rakic PS: Zêdebûna volume û glial
tîrêjiya di korteksa pêşîn a prîmat de bi kronîk ve girêdayî ye
rabûna dermanên antîpsîkotîk. Biol Psychiatry 1999, 46:161~172.
154. Steiner J, Bernstein HG, Bielau H, Farkas N, Winter J, Dobrowolny H, Brisch R,
Gos T, Mawrin C, Myint AM, Bogerts B: glia S100B-immunopozitive e
di paranoîdê de li gorî şîzofreniya mayî bilind dibe: a
lêkolîna morfometrik. J Psychiatr Res 2008, 42:868~876.
155. Carter CJ: eIF2B û zindîbûna oligodendrocyte: li ku derê xweza û mezin dike
bi nexweşiya bipolar û şîzofreniyê re hevdîtin bikin? Schizophr Bull 2007,
33: 1343 1353.
156. Hayashi Y, Nihonmatsu-Kikuchi N, Hisanaga S, Yu XJ, Tatebayashi Y:
Wekhevî û cûdahiyên neuropatolojîk di navbera şîzofreniyê de
û nexweşiya bipolar: lêkolînek mêjî ya paşîn a herikîna sîtometrîk.
PLoS One 2012, 7: e33019.
157. Uranova NA, Vikhreva OV, Rachmanova VI, Orlovskaya DD: Ultrastructural
Guhertinên fîberên myelinated û oligodendrocytes di pêşbirkê de
cortex di şîzofreniyê de: lêkolînek morfometrîkî ya paşverû.
Dermankirina Schizophr Res 2011, 2011: 325789.
158. Torres-Platas SG, Hercher C, Davoli MA, Maussion G, Labonte B, Turecki
G, Mechawar N: Hîpertrofiya astrosîtîkî ya di spîya singûla pêşiyê de
mijara xwekuştinên depresyonê. Neuropsychopharmacology 2011,
36: 2650 2658.
159. Pereira A Jr, Furlan FA: Li ser rola hevdemkirinê ji bo neuron-astrocyte
danûstendin û pêvajoyek hişmendî ya têgihîştî. J Biol Phys 2009,
35: 465 480.
160. Kettenmann H, Hanisch UK, Noda M, Verkhratsky A: Fîzolojiya
mîkroglia. Physiol Rev 2011, 91:461~553.
161. Tremblay ME, Stevens B, Sierra A, Wake H, Bessis A, Nimmerjahn A: Rol
mîkroglia di mêjiyê tendurist de. J Neurosci 2011, 31:16064-16069.
162. Kaindl AM, Degos V, Peineau S, Gouadon E, Chhor V, Loron G, Le
Charpentier T, Josserand J, Ali C, Vivien D, Collingridge GL, Lombet A, Issa L,
Rene F, Loeffler JP, Kavelaars A, Verney C, Mantz J, Gressens P: Çalakkirina
receptorên mîkroglial N-methyl-D-aspartate iltîhaba çêdike û
mirina hucreya neuronal di mêjiyê pêşkeftî û gihîştî de. Ann Neurol
2012, 72:536-549.
163. Schwartz M, Shaked I, Fisher J, Mizrahi T, Schori H: Parastin
xweseriya li hember dijmin di hundurê de: şerkirina jehra glutamate.
Trends Neurosci 2003, 26:297-302.
164. Pacheco R, Gallart T, Lluis C, Franco R: Rola glutamate li ser hucreya T
parastinê navbeynkar. J Neuroimmunol 2007, 185:9-19.
165. Najjar S, Pearlman D, Miller DC, Devinsky O: Epilepsy Refractory related
bi çalakkirina mîkroglial. Neurologist 2011, 17:249�254.
166. Schwartz M, Butovsky O, Bruck W, Hanisch UK: Fenotîpa mîkroglial: e
pabendbûna berepaş? Trends Neurosci 2006, 29:68~74.
167. Wang F, Wu H, Xu S, Guo X, Yang J, Shen X: Koçberiya macrofage
Faktora astengker di çandiniyê de cyclooxygenase 2-prostaglandin E2 çalak dike.
mîkroglia spinal. Neurosci Res 2011, 71:210�218.
168. Zhang XY, Xiu MH, Song C, Chenda C, Wu GY, Haile CN, Kosten TA, Kosten
TR: Serum S100B di bê derman û dermankirî de zêde dibe
nexweşên şîzofrenîk. J Psychiatr Res 2010, 44:1236~1240.
169. Kawasaki Y, Zhang L, Cheng JK, Ji RR: Mekanîzmayên sîtokîn ên navendî
hestiyarbûn: rola cûda û hevgirtî ya interleukin-1beta,
interleukin-6, û faktora nekroza tumor-alpha di rêkûpêkkirina synaptîk û
çalakiya neuronal di palda spînalê de. J Neurosci 2008,
28: 5189 5194.
170. Môller N, Schwarz MJ: Bingeha immunolojîk a glutamatergîk
alozî di şîzofreniyê de: ber bi nêrînek entegre. J Neural
Transm Suppl 2007, 72:269�280.
171. Hestad KA, Tonseth S, Stoen CD, Ueland T, Aukrust P: Asta plazmayê bilind kirin
faktora nekroza tumor a alpha di nexweşên bi depresyonê de: normalîzekirin
di dema tedawiya elektroconvulsive de. J ECT 2003, 19:183-188.
172. Kubera M, Kenis G, Bosmans E, Zieba A, Dudek D, Nowak G, Maes M:
Asta plazmayê ya interleukin-6, interleukin-10, û interleukin-1 receptor
antagonîst di depresyonê de: berhevdana di navbera rewşa akût û piştî
remission. Pol J Pharmacol 2000, 52:237�241.
173. Miller BJ, Buckley P, Seabolt W, Mellor A, Kirkpatrick B: Meta-analîza
Guhertinên cytokine di şîzofreniyê de: rewşa klînîkî û antîpsîkotîk
bandorên. Biol Psychiatry 2011, 70:663-671.
174. Potvin S, Stip E, Sepehry AA, Gendron A, Bah R, Kouassi E: Inflammatory
Guhertinên cytokine di şîzofreniyê de: lêkolînek hejmarî ya sîstematîk.
Biol Psychiatry 2008, 63:801~808.
175. Reale M, Patruno A, De Lutiis MA, Pesce M, Felaco M, Di Giannantonio M, Di
Nicola M, Grilli A: Bêserûberkirina hilberîna kemo-cytokine li
nexweşên şîzofrenîk li hember kontrolên saxlem. BMC Neurosci 2011, 12:13.
176. Fluitman SB, Denys DA, Heijnen CJ, Westenberg HG: Nefret bandorê li TNFalpha dike,
Di nexweşên bi obsessive-mecbûrî de asta IL-6 û noradrenalin
bêsazî. Psychoneuroendocrinology 2010, 35:906-911.
177. Konuk N, Tekin IO, Ozturk U, Atik L, Atasoy N, Bektaş S, Erdogan A: Plasma
astên faktora nekroza tumor-alpha û înterleukîn-6 di obsessive de
nexweşiya mecbûrî. Navbeynkar Inflamm 2007, 2007:65704.
178. Monteleone P, Catapano F, Fabrazzo M, Tortorella A, Maj M: Kêm kirin
asta xwînê ya faktora nekroza tumor-alpha li nexweşên bi obsessivecompulsive
bêsazî. Neuropsychobiology 1998, 37:182-185.
179. Marazziti D, Presta S, Pfanner C, Gemignani A, Rossi A, Sbrana S, Rocchi V,
Ambrogi F, Cassano GB: Guhertinên immunolojîkî yên di obsessivecompulsive mezinan de
bêsazî. Biol Psychiatry 1999, 46:810~814.
180. Zai G, Arnold PD, Burroughs E, Richter MA, Kennedy JL: Nekroza tumor
Gena faktor-alfa bi nexweşiya obsessive-mecbûrî re têkildar nîne.
Psychiatr Genet 2006, 16:43.
181. Rodrôguez AD, Gonzélez PA, Garcâa MJ, de la Rosa A, Vargas M, Marrero F:
Guhertoyên circadian ên di giraniya cytokine ya proînflamatuar de di akût de
enfarktê myokardial. Rev Esp Cardiol 2003, 56:555�560.
182. Oliver JC, Bland LA, Oettinger CW, Arduino MJ, McAllister SK, Aguero SM,
Favero MS: Kînetîka cytokine di modela xwîna tevahî ya in vitro de li jêr
dijwariyek endotoxin. Lymphokine Cytokine Res 1993, 12:115-120.
183. Le T, Leung L, Carroll WL, Schibler KR: Rêzkirina genê interleukin-10
bilêvkirin: mekanîzmayên mimkun ku ji bo bilindkirina wê û ji bo hesabkirin
cudahiyên mazinbûnê di vegotina wê de ji hêla şaneyên mononukleer ên xwînê ve.
Xwîn 1997, 89:4112~4119.
184. Lee MC, Ting KK, Adams S, Brew BJ, Chung R, Guillemin GJ:
Taybetmendiya vegotina receptorên NMDA di mirov de
astrocytes. PLoS One 2010, 5: e14123.
185. Myint AM, Kim YK, Verkerk R, Scharpe S, Steinbusch H, Leonard B:
Rêya Kynurenine di depresyona mezin de: delîlên qelsbûnê
neuroprotection. J Affect Disord 2007, 98:143-151.
186. Sanacora G, Treccani G, Popoli M: Ber bi hîpoteza glutamate ya
depresiyon: sînorek derketî ya neuropsychopharmacology ji bo
nexweşiyên mood. Neuropharmacology 2012, 62:63~77.
187. Saleh A, Schroeter M, Jonkmanns C, Hartung HP, Modder U, Jander S: In
vivo MRI ya iltîhaba mêjî di derbeya iskemîkî ya mirovî de. Mejî 2004,
127: 1670 1677.
188. Tilleux S, Hermans E: Neuroînflammasyon û rêziknameya glial glutamate
girtina di nexweşiyên neurolojîk de. J Neurosci Res 2007, 85:2059-2070.
189. Helms HC, Madelung R, Waagepetersen HS, Nielsen CU, Brodin B: In vitro
delîl ji bo hîpoteza derketina glutamate ya mêjî: endotheliya mêjî
şaneyên ku bi astrosîtan re hevçêkirî ne, mêjî-xwîn-a-yê polarîzekirî nîşan didin
veguhestina glutamate. 2012, 60:882~893.
190. Leonard BE: Têgîna depresyonê wekî xerabûna berevaniyê
sîstem. Curr Immunol Rev 2010, 6:205-212.
191. Labrie V, Wong AH, Roder JC: Beşdariyên riya D-serine ji bo
şîzofreniya. Neuropharmacology 2012, 62:1484-1503.
192. Gras G, Samah B, Hubert A, Leone C, Porcheray F, Rimaniol AC: EAAT
îfadeya ji hêla makrofage û mîkroglia ve: hîn bêtir pirs
bersiv dide. Amino Acids 2012, 42:221�229.
193. Livingstone PD, Dickinson JA, Srinivasan J, Kew JN, Wonnacott S:
Danûstandina glutamate-dopamine di kortika pêşgotinê ya mişkê de ji hêla receptorên nîkotînîkî yên Alpha7 ve tê modul kirin û ji hêla PNU-120596 ve tê xurt kirin. J Mol
Neurosci 2010, 40:172-176.194. Kondziella D, Brenner E, Eyjolfsson EM, Sonnewald U: Çawa glialneuronal
danûstendinên di nav hîpotezên neurotransmitter ên heyî de cih digirin
şîzofreniya? Neurochem Int 2007, 50:291-301.
195. Wu HQ, Pereira EF, Bruno JP, Pellicciari R, Albuquerque EX, Schwarcz R: The
antagonîstê receptorên nîkotîn ên alfa7-astrocyte-astrocyte kynurenic acid
asta glutamate ya derveyî hucreyê di korteksa pêşgotinê de kontrol dike. J Mol
Neurosci 2010, 40:204-210.
196. Steiner J, Bogerts B, Schroeter ML, Bernstein HG: Proteîna S100B di
nexweşiyên neurodejenerative. Clin Chem Lab Med 2011, 49:409�424.
197. Steiner J, Marquardt N, Pauls I, Schiltz K, Rahmoune H, Bahn S, Bogerts B,
Schmidt RE, Jacobs R: Hucreyên CD8(+) T yên mirovan û şaneyên NK îfade dikin û
S100B li ser stimulasyonê derxînin. Brain Behav Immun 2011, 25:1233~1241.
198. Shanmugam N, Kim YS, Lanting L, Natarajan R: Rêziknameya
cyclooxygenase-2 di monocytes de bi girêdana receptorê îfade dike
ji bo hilberên dawiya glycasyonê yên pêşkeftî. J Biol Chem 2003, 278:34834~34844.
199. Rothermundt M, Ohrmann P, Abel S, Siegmund A, Pedersen A, Ponath G,
Suslow T, Peters M, Kaestner F, Heindel W, Arolt V, Pfleiderer B: Hucreya Glial
aktîvkirina di binkomek nexweşên bi şîzofreniyê de ku ji hêla ve hatî destnîşan kirin
asta S100B di serumê de zêde kir û myo-inositol bilind kir.
Prog Neuropsychopharmacol Biol Psychiatry 2007, 31:361�364.
200. Falcone T, Fazio V, Lee C, Simon B, Franco K, Marchi N, Janigro D: Serum
S100B: biyomarkerek potansiyel ji bo xwekujiya di ciwanan de? PLoS One
2010, 5: e11089.
201. Schroeter ML, Abdul-Khaliq H, Krebs M, Diefenbacher A, Blasig IE: Serum
nîşanker di depresyona mezin de patolojiya glial-taybetî ya nexweşiyê piştgirî dikin.
J Affect Disord 2008, 111:271:280.
202. Rothermundt M, Ahn JN, Jorgens S: S100B di şîzofreniyê de: nûvekirinek.
Gen Physiol Biophys 2009, 28 Spec No Focus: F76 F81.
203. Schroeter ML, Abdul-Khaliq H, Krebs M, Diefenbacher A, Blasig IE: Neuronspecific
enolase neguherî ye lê S100B di serumê de bilind dibe
nexweşên bi şîzofreniyê-lêkolîn û meta-analîza eslî.
Psychiatry Res 2009, 167:66~72.
204. Rothermundt M, Missler U, Arolt V, Peters M, Leadbeater J, Wiesmann M,
Rudolf S, Wandinger KP, Kirchner H: Asta xwînê ya S100B di xwînê de zêde bû
Nexweşên şîzofrenîk ên bê derman û dermankirî bi hev ve girêdayî ne
nîşaneyên neyînî. Mol Psychiatry 2001, 6:445~449.
205. Suchankova P, Klang J, Cavanna C, Holm G, Nilsson S, Jonsson EG, Ekman A:
Ma polîmorfîzma Gly82Ser di gena RAGE de têkildar e
şîzofreniya û taybetmendiya kesayetiya psîkotîzmê? J Psychiatry Neurosci
2012, 37:122-128.
206. Scapagnini G, Davinelli S, Drago F, De Lorenzo A, Oriani G: Antîoksîdan wek
antîdepresan: rastî an xeyal? Dermanên CNS 2012, 26:477~490.
207. Ng F, Berk M, Dean O, Bush AI: Stresa oksîdative di nexweşiyên derûnî de:
bingeha delîl û encamên dermankirinê. Int J Neuropsychopharmacol
2008, 11:851-876.
208. Salim S, Chugh G, Asghar M: Inflammation di xemgîniyê de. Adv Protein Chem
Struct Biol 2012, 88:1�25.
209. Anderson G, Berk M, Dodd S, Bechter K, Altamura AC, Dell'osso B, Kanba S,
Monji A, Fatemi SH, Buckley P, Debnath M, Das UN, Meyer U, Mâller N,
Kanchanatawan B, Maes M: Immuno-înflamatuar, oxidative û nîtrosative
stres, û rêyên neuroprogressive di etiolojî, qurs û dermankirinê de
ji şîzofreniyê. Prog Neuropsychopharmacol Biol Psychiatry 2013, 42:1�42.
210. Coughlin JM, Ishizuka K, Kano SI, Edwards JA, Seifuddin FT, Shimano MA,
Daley EL, et al: Kêmkirina berbiçav a superoxide dismutase-1-ê ya çareserkirî
(SOD1) di şilava cerebrospinal de ya nexweşên ku nû dest pê kirine
şîzofreniya. Mol Psychiatry 2012, 18:10�11.
211. Bombaci M, Grifantini R, Mora M, Reguzzi V, Petracca R, Meoni E, Balloni S,
Zingaretti C, Falugi F, Manetti AG, Margarit I, Musser JM, Cardona F, Orefici
G, Grandi G, Bensi G: Profîlkirina rêza proteînê ya sera nexweşên tîk a
bertekek berfireh û berteka berevaniyê ya zêde li dijî Koma A
Antigenên Streptococcus. PLoS One 2009, 4: e6332.
212. Valerio A, Cardile A, Cozzi V, Bracale R, Tedesco L, Pisconti A, Palomba L,
Cantoni O, Clementi E, Moncada S, Carruba MO, Nisoli E: TNF-alpha
îfadeya eNOS û biyojeneya mîtokondrî ya di rûnê de kêm dike
û masûlkeyên rovîyên qelew. J Clin Invest 2006, 116:2791�2798.
213. Ott M, Gogvadze V, Orrenius S, Zhivotovsky B: Mitochondria, oxidative
stres û mirina hucreyê. Apoptosis 2007, 12:913-922.
214. Shalev H, Serlin Y, Friedman A: Şikandina berbenda xwînê-mêjî wekî dergeh
ji bo nexweşiya derûnî. Neurol Psychiatry Cardiovasc 2009, 2009: 278531.
215. Abbott NJ, Ronnback L, Hansson E: Têkiliyên astrocyte-endothelial li
astengiya xwînê-mêjî. Nat Rev Neurosci 2006, 7:41�53.
216. Bechter K, Reiber H, Herzog S, Fuchs D, Tumani H, Maxeiner HG:
Di spektora bandor û şîzofrenîk de analîza şilava cerebrospinal
nexweşî: naskirina binekomên bi bersivên parastinê û
xerabûna astengiya xwînê-CSF. J Psychiatr Res 2010, 44:321�330.
217. Harris LW, Wayland M, Lan M, Ryan M, Giger T, Lockstone H, Wuethrich I,
Mimmack M, Wang L, Kotter M, Craddock R, Bahn S: Mejî
microvasculature di şîzofreniyê de: lêkolînek girtina lazerê ya microdissection.
PLoS One 2008, 3: e3964.
218. Lin JJ, Mula M, Hermann BP: Rakirina neurobehavioural
nexweşiyên hevgirtî yên epîlepsiyê di temenê de. Lancet 2012, 380:1180~1192.
219. Isingrini E, Belzung C, Freslon JL, Machet MC, Camus V: Bandora Fluoxetine li ser
vasorelaxation-girêdayî nîtrîk oxide aortîk di nepêşbînîkirin
Modela stresa sivik a kronîk a depresyonê di mişkan de. Psychosom Med 2012,
74: 63 72.
220. Zhang XY, Zhou DF, Cao LY, Zhang PY, Wu GY, Shen YC: Bandora
Dermankirina risperidone li ser superoxide dismutase di şîzofreniyê de. J Clin
Psychopharmacol 2003, 23:128-131.
221. Lavoie KL, Pelletier R, Arsenault A, Dupuis J, Bacon SL: Komela di navbera
depresyona klînîkî û fonksiyona endotelîal bi pêşiyê tê pîvandin
reaksiyona hîperemîk. Psychosom Med 2010, 72:20�26.
222. Chrapko W, Jurasz P, Radomski MW, Archer SL, Newman SC, Baker G, Lara N,
Le Melledo JM: Guherîna kêmbûna metabolîtên NO yên plazmayê û
Di nexweşên depresyonî de çalakiya NO synthase ya trombocitî ji hêla paroxetine ve.
Neuropsychopharmacology 2006, 31:1286-1293.
223. Chrapko WE, Jurasz P, Radomski MW, Lara N, Archer SL, Le Melledo JM:
Kêmbûna çalakiya synthase ya nitric oxide ya trombocitê û nitric oxide ya plazmayê
metabolîtan di nexweşiya depresyonê ya mezin de. Biol Psychiatry 2004, 56:129~134.
224. Stuehr DJ, Santolini J, Wang ZQ, Wei CC, Adak S: Nûvekirina li ser mekanîzmayê
û rêziknameya katalîtîk di sentazên NO de. J Biol Chem 2004,
279: 36167 36170.
225. Chen W, Druhan LJ, Chen CA, Hemann C, Chen YR, Berka V, Tsai AL, Zweier
JL: Peroxynitrite hilweşandina tetrahydrobiopterin û
heme di senttaza nîtrîk oksîdê endotelîal de: derbasbûna ji vegerê ber bi
astengkirina enzîmê ya bêveger. Biochemistry 2010, 49:3129~3137.
226. Chen CA, Wang TY, Varadharaj S, Reyes LA, Hemann C, Talukder MA, Chen
YR, Druhan LJ, Zweier JL: S-glutathionylation eNOS û
fonksiyona xwe ya hucreyî û damarî birêkûpêk dike. Xweza 2010, 468:1115~1118.
227. Szabo C, Ischiropoulos H, Radi R: Peroxynitrite: biyokîmya,
pathophysiology û pêşveçûna dermankirinê. Nat Rev Drug Discov
2007, 6:662-680.
228. Papakostas GI, Shelton RC, Zajecka JM, Etemad B, Rickels K, Clain A, Baer L,
Dalton ED, Sacco GR, Schoenfeld D, Pencina M, Meisner A, Bottiglieri T,
Nelson E, Mischoulon D, Alpert JE, Barbee JG, Zisook S, Fava M: Lmethylfolate
wekî terapiya pêvek ji bo depresyona mezin a SSRI-berxwedêr:
encamên du ceribandinên rasthatî, du-kor, paralel-rêkûpêk. Am J
Psychiatry 2012, 169:1267~1274.
229. Antoniades C, Shirodaria C, Warrick N, Cai S, de Bono J, Lee J, Leeson P,
Neubauer S, Ratnatunga C, Pillai R, Refsum H, Channon KM: 5-
methyltetrahydrofolate bi lez fonksiyona endotelyal çêtir dike û
hilberîna superoksîdê di damarên mirovan de kêm dike: bandorên li ser damaran
hebûna tetrahydrobiopterin û endothelial oxide oxide synthase
coupling. Tiraja 2006, 114:1193�1201.
230. Masano T, Kawashima S, Toh R, Satomi-Kobayashi S, Shinohara M, Takaya T,
Sasaki N, Takeda M, Tawa H, Yamashita T, Yokoyama M, Hirata K: Bifeyde
bandorên tetrahydrobiopterina exogenous li ser nûvekirina ventricular çepê
piştî enfeksiyona myokardial di mişkan de: rola gengaz a stresê oksîdative
ji hêla endotelyal nitric oxide synthase ve girêdayî ye. Circ J 2008,
72: 1512 1519.
231. Alp NJ, Channon KM: Rêzkirina endothelial nîtric oxide synthase ji hêla
tetrahydrobiopterin di nexweşiya damaran de. Arterioscler Thromb Vasc Biol 2004,
24: 413 420.
232. Szymanski S, Ashtari M, Zito J, Degreef G, Bogerts B, Lieberman J:
Gadolinium-DTPA di nav de îskanên rezonansa echo magnetîkî ya gradient zêdekirî
qonaxa yekem a psîkoz û nexweşên şîzofrenîkî yên kronîk.
Psychiatry Res 1991, 40:203~207.
233. Butler T, Weisholtz D, Isenberg N, Harding E, Epstein J, Stern E, Silbersweig
D: Neuroimaging ya bêfonksiyona eniya-lîmbîk di şîzofreniyê û
Psîkoza girêdayî serpêbûnê: ber bi neurobiolojiya hevgirtî ve.
Epilepsy Behav 2012, 23:113�122.234. Butler T, Maoz A, Vallabhajosula S, Moeller J, Ichise M, Paresh K, Pervez F,
Friedman D, Goldsmith S, Najjar S, Osborne J, Solnes L, Wang X, J French,
Thesen T, Devinsky O, Kuzniecky R, Stern E, Silbersweig D: Imaging
iltîhaba di nexweşek bi epîlepsiyê de bi antîkoran re têkildar e
glutamic acid decarboxylase [kurtaj]. Di Abstractên Am Epilepsy Society de,
Volume 2. Baltimore: American Epilepsy Society; 2011:191.
235. van Berckel BN, Bossong MG, Boellaard R, Kloet R, Schuitemaker A, Caspers
E, Luurtsema G, Windhorst AD, Cahn W, Lammertsma AA, Kahn RS:
Di şîzofreniya nû-destpêkirî de aktîvkirina mîkroglia: mîqdarek (R)-
[11C] PK11195 lêkolîna tomografya emîsyona pozîtronê. Biol Psychiatry 2008,
64: 820 822.
236. Doorduin J, de Vries EF, Willemsen AT, de Groot JC, Dierckx RA, Klein HC:
Neuroinflammation di psîkoza bi şîzofreniyê de: lêkolînek PET.
J Nucl Med 2009, 50:1801-1807.
237. Takano A, Arakawa R, Ito H, Tateno A, Takahashi H, Matsumoto R, Okubo Y,
Suhara T: Receptorên benzodiazepînê yên periferîkî di nexweşên bi kronîk de
şîzofreniya: lêkolînek PET bi [11C] DAA1106. Int J
Neuropsychopharmacol 2010, 13:943~950.
238. M�ller N, Schwarz MJ, Dehning S, Douhe A, Cerovecki A, Goldstein-Muller B,
Spellmann I, Hetzel G, Maino K, Kleindienst N, Mâller HJ, Arolt V, Riedel M:
Inhibitorê cyclooxygenase-2 celecoxib di nav de bandorên dermankirinê hene
depresyonek mezin: encamên du-kor, randomkirî, placebo
kontrolkirî, lêzêdekirina lêkolîna pîlot a reboxetine. Mol Psychiatry 2006,
11: 680 684.
239. Akhondzadeh S, Jafari S, Raisi F, Nasehi AA, Ghoreishi A, Salehi B, MohebbiRasa
S, Raznahan M, Kamalipour A: Dadgehkirina klînîkî ya celecoxib a adjunctive
dermankirina li nexweşên bi depresyona mezin: du kor û
ceribandina kontrolkirî ya placebo. Xemgîniya Depresyonê 2009, 26:607-611.
240. Mendlewicz J, Kriwin P, Oswald P, Souery D, Alboni S, Brunello N:
Di depresyonên mezin de destpêka çalakiya antîdepresanan kurt kirin
Zêdekirina asîdê acetylsalicylic: lêkolînek pîlot a vekirî. Int Clin
Psychopharmacol 2006, 21:227-231.
241. Uher R, Carver S, Power RA, Mors O, Maier W, Rietschel M, Hauser J,
Dernovsek MZ, Henigsberg N, Souery D, Placentino A, Cotkar A, McGuffin P:
Dermanên dijî-înflamatuar ên ne-steroîdal û bandora antîdepresanan di nav de
nexweşiya depresyonê ya mezin. Psychol Med 2012, 42:2027–2035.
242. Mâller N, Riedel M, Scheppach C, Brandstatter B, Sokullu S, Krampe K,
Ulmschneider M, Engel RR, Moller HJ, Schwarz MJ: Antîpsîkotîk bikêr
bandorên dermankirina pêvek a celecoxib li gorî risperidone tenê tê de
şîzofreniya. Am J Psychiatry 2002, 159:1029-1034.
243. Miller N, Riedel M, Schwarz MJ, Engel RR: Bandorên klînîkî yên COX-2
astengkerên li ser zanînê di şîzofreniyê de. Eur Arch Psychiatry Clin Neurosci
2005, 255:149-151.
244. Mâller N, Krause D, Dehning S, Musil R, Schennach-Wolff R, Obermeier M,
Moller HJ, Klauss V, Schwarz MJ, Riedel M: Dermankirina Celecoxib di destpêkê de
qonaxa şîzofreniyê: encamên randomkirî, du-kor, cihê-kontrolkirî
ceribandina celecoxib zêdekirina dermankirina amisulpride.
Schizophr Res 2010, 121:118�124.
245. Sayyah M, Boostani H, Pakseresht S, Malayeri A: A pêşîn a rasthatî
ceribandina klînîkî ya du-kor li ser bandoriya celecoxib wekî alîkariyek di nav de
dermankirina nexweşiya obsessive-mecbûrî. Psychiatry Res 2011,
189: 403 406.
246. Sublette ME, Ellis SP, Geant AL, Mann JJ: Meta-analîza bandorên
eicosapentaenoic acid (EPA) di ceribandinên klînîkî de di depresyonê de. J Clin
Psychiatry 2011, 72:1577~1584.
247. Bloch MH, Hannestad J: Asîdên rûn ên Omega-3 ji bo dermankirina
depresiyon: vekolîna sîstematîk û meta-analîz. Mol Psychiatry 2012,
17: 1272 1282.
248. Keller WR, Kum LM, Wehring HJ, Koola MM, Buchanan RW, Kelly DL: A
lêkolîna ajanên dijî-înflamatuar ji bo nîşanên şîzofreniyê.
J Psychopharmacol.
249. Warner-Schmidt JL, Vanover KE, Chen EY, Marshall JJ, Greengard P:
Bandorên antîdepresant ên înhîbîtorên vegerandina serotonin bijartî (SSRI)
di mişk û mirovan de bi dermanên antîînflamatuar têne kêmkirin. Proc Natl
Acad Sci USA 2011, 108:9262-9267.
250. Gallagher PJ, Castro V, Fava M, Weilburg JB, Murphy SN, Gainer VS, Churchill
SE, Kohane IS, Iosifescu DV, Smoller JW, Perlis RH: Bersiva antîdepresan
di nexweşên bi depresyonek mezin de ku bi NSAIDs re rû bi rû ne: a
lêkolîna pharmacovigilance. Am J Psychiatry 2012, 169:1065-1072.
251. Shelton RC: Ma bikaranîna hevdemî ya NSAIDs bandorkeriya kêm dike
antîdepresanan? Am J Psychiatry 2012, 169:1012-1015.
252. Martinez-Gras I, Perez-Nievas BG, Garcia-Bueno B, Madrigal JL, AndresEsteban
E, Rodriguez-Jimenez R, Hoenicka J, Palomo T, Rubio G, Leza JC:
Prostaglandin 15d-PGJ2 dijî-înflamatuar û receptora wê ya nukleerî
PPARgamma di şîzofreniyê de kêm dibe. Schizophr Res 2011,
128: 15 22.
253. Garcia-Bueno B, Perez-Nievas BG, Leza JC: Ma rola navokî heye?
receptor PPARgamma di nexweşiyên neuropsîkiyatrîk de? Int J
Neuropsychopharmacol 2010, 13:1411~1429.
254. Meyer U: Di şîzofreniyê de sînyala dijî-înflamatuar. Brain Behav
Immun 2011, 25:1507-1518.
255. Ramer R, Heinemann K, Merkord J, Rohde H, Salamon A, Linnebacher M,
Hinz B: COX-2 û PPAR-gama apoptoza ku bi cannabidiol ve hatî çêkirin vedigire
hucreyên kansera pişika mirovan. Mol Cancer Ther 2013, 12:69~82.
256. Henry CJ, Huang Y, Wynne A, Hanke M, Himler J, Bailey MT, Sheridan JF,
Godbout JP: Minocycline lipopolysaccharide (LPS)-hilweşîn kêm dike
neuroinflammation, tevgera nexweşî, û anhedonia.
J Neuroinflammation 2008, 5:15.
257. Sarris J, Mischoulon D, Schweitzer I: Omega-3 ji bo nexweşiya bipolar: metaanalîz
bikaranîna di mania û depresyonê bipolar. J Clin Psychiatry 2012,
73: 81 86.
258. Amminger GP, Schafer MR, Papageorgiou K, Klier CM, Cotton SM, Harrigan
SM, Mackinnon A, McGorry PD, Berger GE: Asîdên rûn ên omega-3-zincîra dirêj
ji bo pêşîlêgirtina diyarkirî ya nexweşiyên psîkotîkî: a rasthatî, cîhêkontrolkirî
bazarî. Arch Gen Psychiatry 2010, 67:146-154.
259. Fusar-Poli P, Berger G: Destwerdanên asîda Eicosapentaenoic di
şîzofreniya: meta-analîzek lêkolînên randomkirî, cîhê-kontrolkirî.
J Clin Psychopharmacol 2012, 32:179-185.
260. Zorumski CF, Paul SM, Izumi Y, Covey DF, Mennerick S: Neurosteroids,
stres û depresyonê: Derfetên dermankirinê yên potansiyel.
Neurosci Biobehav Rev 2013, 37:109�122.
261. Uhde TW, Singareddy R: Lêkolîna Biyolojîkî Di Nexweşiyên Xemgîniyê de. Li
Psîkiyatrî wekî Neuroscience. Ji hêla Juan Jose LI, Wolfgang G, Mario M ve hatî verast kirin,
Norman S. Chichester: John Wiley & Sons, Ltd; 2002:237.
262. Gibson SA, Korado Z, Shelton RC: Stresa oksîdative û glutathione
bersiva di çandên tevnvîsê de ji kesên bi depresyona mezin re.
J Psychiatr Res 2012, 46:1326-1332.
263. Nery FG, Monkul ES, Hatch JP, Fonseca M, Zunta-Soares GB, Frey BN,
Bowden CL, Soares JC: Celecoxib wekî alîkariyek di dermankirinê de
episodesên depresîv an tevlihev ên nexweşiya bipolar: du-kor,
lêkolîna randomîzekirî, cîhê-kontrolkirî. 2008, 23:87.
264. Levine J, Cholestoy A, Zimmerman J: Bandora antîdepresantî ya gengaz a
minocycline. 1996, 153:582.
265. Levkovitz Y, Mendlovich S, Riwkes S, Braw Y, Levkovitch-Verbin H, Gal G,
Fennig S, Treves I, Kron S: Lêkolînek du-kor, rasthatî ya
minocycline ji bo dermankirina nîşanên neyînî û cognitive li
şîzohpreniya qonaxa destpêkê. J Clin Psychiatry 2010, 71:138-149.
266. Miyaoka T, Yasukawa R, Yasuda H, Hayashida M, Inagaki T, Horiguchi J:
Bandora antîpsîkotîkî ya muhtemel a minocycline di nexweşan de
şîzofreniya. Prog Neuropsychopharmacol Biol Psychiatry 2007, 31:304-307.
267. Miyaoka J, Yasukawa R, Yasuda H, Hayashida M, Inagaki T, Horiguchi J:
Minocycline wekî tedawiya pêvek ji bo şîzofreniyê: nîşanek vekirî
xwendina zanko. 2008, 31:287-292.
268. Rodriguez CI, Bender J Jr, Marcus SM, Snape M, Rynn M, Simpson HB:
Zêdekirina minocycline ya dermankoterapiya di obsessive-mecbûrî de
nexweşî: ceribandinek vekirî. 2010, 71:1247-1249.
doi:10.1186/1742-2094-10-43
Vê gotarê wekî: Najjar et al.: Neuroinflammation û derûnî
nexweşî. Kovara Neuroinflammation 2013 10:43.
Accordion Close
Agahdariya li ser "Neuroinflammasyon û Nexweşiya Piksyonîkî" ne armanc e ku têkiliyek yek-bi-yek bi pisporek lênihêrîna tenduristî ya jêhatî an bijîjkek destûrdar re biguhezîne û ne şîreta bijîjkî ye. Em we teşwîq dikin ku hûn li gorî lêkolîn û hevkariya xwe bi pisporek lênihêrîna tenduristî ya jêhatî re biryarên lênihêrîna tenduristiyê bidin.
Agahdariya Blog & Nîqaşên Berfireh
Qada agahdariya me bi Chiropractic, musculoskeletal, dermanên laşî, tenduristî, beşdariya etiolojîk ve sînorkirî ye nexweşiyên viscerosomatîk di nav pêşandanên klînîkî de, dînamîkên klînîkî yên refleksa somatovisceral ên têkildar, kompleksên subluksasyonê, pirsgirêkên tenduristiyê yên hesas, û / an gotar, mijar û nîqaşên dermanê fonksiyonel.
Em pêşkêş dikin û pêşkêş dikin hevkariya klînîkî bi pisporên ji dîsîplînên cuda. Her pispor ji hêla qada pratîkê ya pîşeyî û dadrêsiya lîsansê ve tê rêve kirin. Em protokolên tenduristî û başbûnê yên fonksiyonel bikar tînin da ku ji bo birîn an nexweşiyên pergala masûlkeyê derman bikin û piştgirî bikin.
Vîdyo, post, mijar, mijar û têgihiştinên me mijarên klînîkî, pirsgirêk û mijarên ku têkildar in û rasterast an nerasterast piştgirî didin qada pratîka meya klînîkî vedigirin.*
Ofîsa me bi awayekî maqûl hewl daye ku navgînên piştgirî peyda bike û lêkolîna lêkolînê an lêkolînên têkildar ên ku postên me piştgirî dikin nas kiriye. Em li ser daxwazê kopiyên lêkolînên piştevaniya lêkolînan ji bo desteyên nîzam û raya giştî peyda dikin.
Em fêhm dikin ku em mijarên ku vegotinek din hewce dike vedihewîne ka ew çawa dikare di nexşeya lênihînê an protokola dermankirinê ya taybetî de bibe alîkar; ji ber vê yekê, ji bo ku em li jor mijara li jor nîqaş bikin, ji kerema xwe bipirsin Dr. Alex Jimenez, DC, An bi me re têkilî bikin 915-850-0900.
Em li vir in ku alîkariya we û malbata we bikin.
Pîroziya
Dr. Alex Jimenez D.C., MSACP, RN*, CCST, IFMCP*, CIFM*, atn*
email: coach@elpasofunctionalmedicine.com
Di nav de wekî Doktorê Chiropractic (DC) destûrdayî ye texas & New Mexico*
Lîsanseya Texas DC # TX5807, New Mexico DC License # NM-DC2182
Wekî hemşîreyek Qeydkirî (RN*) destûrdar e in florida
Florida License RN License de # RN9617241 (Kontrol No. 3558029)
Rewşa kompakt: License de pir-dewletê: Desthilatdar e ku di pratîkê de Dewletên 40*
Alex Jimenez DC, MSACP, RN* CIFM*, IFMCP*, ATN*, CCST Dr.
Karta Karsaziya Min a Dîjîtal