Laşên keton ji hêla kezebê ve têne çêkirin û wekî çavkaniyek enerjiyê têne bikar anîn dema ku glukoz di laşê mirovan de bi hêsanî peyda nebe. Du laşên ketone yên sereke acetoacetate (AcAc) û 3-beta-hydroxybutyrate (3HB) ne, dema ku aceton laşê ketone yê sêyemîn û herî kêm e. Ketone her tim di xwînê de hene û di dema rojîgirtin û werzîşên dirêj de asta wan zêde dibe.Ketogenesis Pêvajoya biyokhemîk e ku bi organîzasyonên bi destûra bedenên hilanîna acîdên acîl û amino ketogenic.
Destên Ketone di bin mitokondria ya hucreyên liverê. Ketogenesis di dema xwînê de kêm li glucose kêm dibe, bi taybetî li dû firotanên carbohydrate, wekî glycogen, paqij kirin. Ev mekanîzmîzmê dikare dema ku bêhtir heb an insulin ne. Hilberîna saziyên ketone di dawiyê de dest pê kir ku desthilatiya enerjiyê çêbikin ku di bedenê mirovan de wekî fîdî fatikê tomar kirin. Ketogenesis di mitochondria de li ser ku tê de serbixwe bi rê ve tête pêk tê.
Contents
Abstract
Laşê metabolîzma Ketone ya navenda navxweyî ya fîzîkîolojî ye. Di vê nirxandinê de, em gotûbêj dikin ku çêdikên ku konsolên mîkabolê yên erênabolê yên berbiçav digire, ku organîzasyon û organîzmîzmê di cûdawareka cîhêreng de dimîne û pergalên gelek organên organî yên ji organê gelek organan biparêzin. Bi kevneşopî wek metabolic metrîkan tenê di binpêkirina sînorên carbohydrate de têne dîtin, çavdêranên paşîn ên nirxên girîng ên koneonê wekî wek carbohydratek pir pir girîng e. Têkilînek revertoire ku ji bo nexweşiyên nervous yên tê zanîn, ji bo laşên kansê yên kansiyonê yên ku di kanserê deverî û guravên di ewlehiyê de hewl didin hewl didin, alternatîvên dermankirinê yên di obesity-related and cardiovascular de vedigirin. Têkiliyên di metabolîzmê û sembolên ketone de gotûbêj kirin ku bi çavdêriya klîmîk bi hevpeyvînên hevdem ên hevrêz bikin.
Pêşkêş
Laşên ketonî ji bo hemî qadên jiyanê, eukarya, bakterî û arkeayan çavkaniyek sotemeniya metabolîk a alternatîf girîng in (Aneja et al., 2002; Cahill GF Jr, 2006; Krishnakumar et al., 2008). Metabolîzma laşê ketonê di mirovan de tê xebitandin ku mêjî di serdemên episodîk ên bêparbûna xurek de bişewitîne. Laşên ketonî bi riyên girîng ên metabolê yên mammalan ên wekî ?-oksîdasyon (FAO), çerxa asîda tricarboxylic (TCA), glukoneogenesis, de novo lipogenesis (DNL) û biosenteza sterolan ve girêdayî ne. Di memikan de, laşên ketone bi giranî di kezebê de ji acetyl-CoA-ya ku ji FAO-yê hatî hilberandin, têne hilberandin, û ew ji bo oksîdasyona termînalê ber bi tevnên ekstrahepatîk ve têne şandin. Ev fîzolojî sotemeniyek alternatîf peyda dike ku ji hêla demên kurt ên rojiyê ve tê zêdekirin, ku hebûna asîdên rûnê zêde dike û hebûna karbohîdartan kêm dike (Cahill GF Jr, 2006; McGarry and Foster, 1980; Robinson and Williamson, 1980). Oksîdasyona laşê keton dibe alîkarek girîng ji metabolîzma enerjiyê ya giştî ya mammalan di nav tevnvîsên ekstrahepatîk de di nav gelek rewşên fîzyolojîk de, di nav de rojîgirtin, birçîbûn, heyama neonatal, piştî werzîşê, ducanîbûn, û pabendbûna bi parêzên kêm karbohîdartan. Di nav mirovên mezin ên saxlem de tevheviya laşê ketonê di nav mirovên tendurist de bi gelemperî di navbera 100-250 �M de levhatinên dorhêlê nîşan didin, piştî werzîşê ya dirêj an 1 demjimêran rojîgirtinê digihîje ~24 mM, û dikare di rewşên patholojîkî yên mîna ketoacidosis diyabetê de bi qasî 20 mM kom bibe. Cahill GF Jr, 2006; Johnson et al., 1969b; Koeslag et al., 1980; Robinson and Williamson, 1980; Wildenhoff et al., 1974). Kezeba mirov rojê heta 300 g laşên ketone çêdike (Balasse and Fery, 1989), ku di navbera 5-20% ji xerckirina enerjiyê ya tevahî di dewletên têr, rojî û birçî de beşdar dibe (Balasse et al., 1978; Cox et. al., 2016).
Niha lêkolînên nû yên ji bo laşên ketone yên di navmalê mammaliyan de, hûrgelan, homostostasis, û navnîşên cûda yên dewletên fîzîkî û fikolojîk de bin nîşan dikin. Ji bilî ku ji bo fuelên enerjiyê yên ji bo mestirên derheqê mizgeft, dil, an jî pişkek çermê, ketone bodyên ketone, wekî navbeynkarên sembolandinê, lîstikvanên paşerojê yên piştî post-guhertinê (PTM), û modulatorên tehsîl û germiya oksîterê lîstin. Di vê çavkaniyê de, em nêrînên hemî û modern ên hemî rolên pleiotropîk ên saziyên ketone û metabolîzmê wan dikin.
Nirxandina Ketone Body Metabolîzmê
Rêjeya ketogeneza kezebê ji hêla rêzikek veguheztinên fîzyolojîk û biyolojîk ên rûnê ve tê rêve kirin. Rêbazên seretayî lîpolîza asîdên rûn ên ji triacilglycerolan, veguheztina berbi û li ser parzûna plasma ya kezebê, veguheztina nav mitokondriyayê bi riya carnitine palmitoyltransferase 1 (CPT1), spiral ?-oksîdasyon, çalakiya çerxa TCA û giraniya navîn, potansiyela redoksîtê, û ji van pêvajoyan, bi giranî glukagon û însulîn [di lêkolînê de (Arias et al., 1995; Ayte et al., 1993; Ehara et al., 2015; Ferre et al., 1983; Kahn et al., 2005; McGarry and Foster , 1980; Williamson et al., 1969)]. Klasîk ketogenesis wekî rêgezek rijandinê tê dîtin, ku tê de acetil-CoA-ya ku ji ?-oksîdasyonê hatî wergirtin ji çalakiya synthase ya citrate û/an hebûna oxaloacetate ji bo kondensasyonê ji bo avakirina citratê derbas dibe. Navberên sê-karbonî çalakiya antî-ketogenîk nîşan didin, dibe ku ji ber şiyana wan a berfirehkirina hewza oxaloacetate ji bo vexwarina acetyl-CoA, lê giraniya acetyl-CoA kezebê tenê rêjeya ketogenîk diyar nake (Foster, 1967; Rawat and Menahan, 1975; Williamson et al., 1969). Rêzkirina ketogenesisê ji hêla bûyerên hormonal, transkrîpsîyonî, û piştî-wergerandinê ve bi hev re piştgirî dide vê têgînê ku mekanîzmayên molekulî yên ku rêjeya ketogenîk baş rast dikin bi tevahî nayê fam kirin (binêre Rêziknameya HMGCS2 û SCOT/OXCT1).
Ketogenesis di serî de di matrixa mîtokondrî ya kezebê de bi rêjeyên ku bi oksîsyona rûnê ya tevahî re têkildar pêk tê. Piştî veguheztina zincîreyên acîl li ser parzûnên mîtokondrî û ?-oksîdasyon, îzoforma mîtokondrî ya 3-hîdroksîmethylglutaryl-CoA synthase (HMGCS2) qedera ku kondensasyona acetoacetyl-CoA (AcAc-CoA) û acetylMGCoA çêdike katalîze dike. (Hêjîra 1A). HMG-CoA lyase (HMGCL) HMG-CoA vediqetîne da ku acetyl-CoA û acetoacetate (AcAc) azad bike, û ya paşîn ji hêla d-?OHB mitochondrial (d-?OHB) ve girêdayî dibe d-?-hydroxybutyrate (d-?OHB) BDH1) di reaksiyonek nêzîk-hevsengiya NAD+/NADH de (Bock and Fleischer, 1975; LEHNINGER et al., 1960). Berdewamiya hevsengiya BDH1 hilberîna d-?OHB xweş dike, lê rêjeya laşên ketone yên AcAc/d-?OHB rasterast bi rêjeya NAD+/NADH ya mitokondrî re têkildar e, û bi vî rengî çalakiya BDH1 oxidoreductase potansiyela redoksa mîtokondrîal modul dike (Krebs et al., 1969, Williamson et al., 1967). AcAc di heman demê de dikare bixweber dekarboksîlate bike acetonê (Pedersen, 1929), çavkaniya bîhnxweşiya xweş di mirovên ku ketoacidosis dikişînin (ango, laşên ketone yên serumê yên tevahî > ~ 7 mM; AcAc pKa 3.6, ?OHB pKa 4.7). Mekanîzmayên ku bi navgîniya cesedên ketone di nav perdeya hundurîn a mîtokondrial de têne veguheztin nayên zanîn, lê AcAc/d-?OHB ji hucreyan bi navgîniya veguhezkerên monokarboksîlate têne berdan (di memikan de, MCT 1 û 2, ku wekî hilgirê solute 16A endamên malbata 1 û 7) û ji bo oksîdasyona termînalê di nav gerîdeyê de berbi tevnên derhepatîk ve tê veguheztin (Cotter et al., 2011; Halestrap and Wilson, 2012; Halestrap, 2012; Hugo et al., 2012). Tevnhevkirina laşên ketonê yên gerok ji yên di nav tevnên ekstrahepatîk de bilindtir in (Harrison and Long, 1940) ev destnîşan dike ku laşên ketone di nav deverek hûrbûnê de têne veguheztin. Mutasyonên windabûna fonksiyonê di MCT1 de bi pêlên xwebexşî yên ketoacidosis re têkildar in, ku di importa laşê ketone de rolek girîng pêşniyar dike.
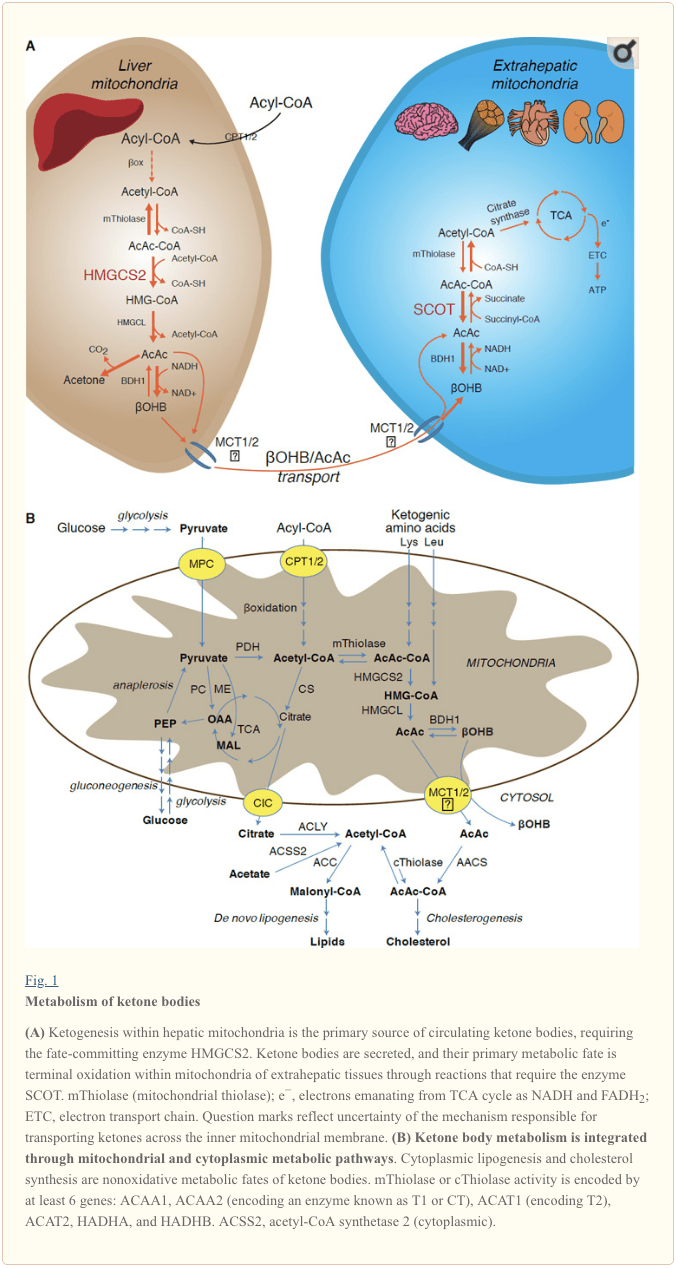
� Ji bilî veguhertina potansiyel a laşên ketone ber bi çarenûsên ne-oksîdatîf (binihêrin çarenûsa metabolîk a ne-oksîdatîf a laşên ketone), hepatocîtan kêmasiya metabolîzma laşên ketone yên ku ew çêdikin tune. Cenazeyên keton ên ku ji hêla kezebê ve ji nû ve têne sentez kirin (i) di mîtokondrîya tevnên derveyî kezebê de berbi acetyl-CoA ve têne katabolîzekirin, ya ku ji bo oksîsyona termînalê ji çerxa TCA re peyda dibe (Wêne. 1A), (ii) ber bi rêyên lipogenesis an senteza sterolê ve têne veguheztin (ii) Fig. 1B), an (iii) di mîzê de derdixe. Wekî sotemeniyek enerjîk a alternatîf, laşên ketone di dil, masûlkeyên skeletal û mêjî de bi dilxwazî têne oksîd kirin (Balasse and Fery, 1989; Bentourkia et al., 2009; Owen et al., 1967; Reichard et al., 1974; Sultan, 1988 ). BDH1 mîtokondrîya derveyî kezebê reaksiyona yekem a oksîdasyona ?OHB katalîze dike, wê vediguheze AcAc (LEHNINGER et al., 1960; Sandermann et al., 1986). D-?OHB-dehydrogenase (BDH2) ya sîtoplazmîkî ya ku bi tenê 20% nasnameya rêzê ya BDH1 heye Km bilind ji bo laşên ketone heye, û di heman demê de di homeostaza hesin de jî rolek dilîze (Davuluri et al., 2016; Guo et al., 2006) . Di matrixa mîtokondrî ya derveyî kezebê de, AcAc bi veguheztina parek CoA-yê ji succinyl-CoA ve di reaksiyonê de ku ji hêla veguhezek CoA-ya mammalek yekta, succinyl-CoA: 3-oxoacid-CoA transferase (SCOT, CoA transferase) ve hatî katalîzekirin, li AcAc-CoA tê çalak kirin. ji hêla OXCT1 ve hatî kod kirin), bi reaksiyonek hevsengî ya nêzîk. Enerjiya belaş a ku ji hêla hîdrolîza AcAc-CoA ve hatî berdan ji ya succinyl-CoA mezintir e, ku avakirina AcAc-ê xweş dike. Ji ber vê yekê herikîna oksîtîf a laşê ketone ji ber çalakiya girseyî pêk tê: peydakirina zêde ya AcAc û vexwarina bilez a acetil-CoA bi navgîniya synthase citrate ji avakirina AcAc-CoA (+ succinate) ji hêla SCOT ve dibe alîkar. Nemaze, berevajî glukozê (hexokinase) û asîdên rûn (astîl-CoA synthetases), aktîvkirina laşên ketone (SCOT) di formek oksîdkirî de hewcedariya veberhênana ATP nake. Reaksiyonek tîolazê ya AcAc-CoA ya vegerî [ku ji hêla yek ji çar thiolazên mîtokondrî ve hatî katalîz kirin ku ji hêla ACAA2 (enzîmek ku wekî T1 an CT kod dike), ACAT1 (T2 şîfre dike), HADHA, an HADHB ve hatî kod kirin) du molekulên acetyl-CoA derdixe, ku dikevin dewra TCA (Hersh and Jencks, 1967; Stern et al., 1956; Williamson et al., 1971). Di dema rewşên ketotîk de (ango, ketonên serûmê yên tevahî > 500 �M), laşên ketone dibin alîkarên girîng ji lêçûnên enerjiyê re û bi lez di nav tevnan de têne bikar anîn heya ku hilgirtin an têrbûna oksîdasyonê pêk were (Balasse et al., 1978; Balasse and Fery, 1989 Edmond et al., 1987). Parçeyek pir piçûk a laşên ketone yên kezebê dikare bi hêsanî di mîzê de were pîvandin, û rêjeyên bikar anîn û vegerandinê ji hêla gurçikê ve bi giraniya gerokê re têkildar in (Goldstein, 1987; Robinson and Williamson, 1980). Di dema rewşên pir ketotîk de (> 1 mM di plazmayê de), ketonuria wekî nûçegihanek nîv-hejmarî ya ketosis kar dike, her çend piraniya ceribandinên klînîkî yên laşên ketone yên mîzê AcAc tespît dikin lê ne ?OHB (Klocker et al., 2013).
Metabolîzmê li Hepatocyte ya Metabolîzmê ya Ketogenic û Bandora wan
Substrates yên katogenic hene hene ku acil û amino acids (Nig 1B). Catabolîzma ya amino acids, bi taybetî bi leucine, li ser 4% body of ketone di dewleta paşveçûnê de (hilberîn û alî, 1982). Ji ber vê yekê acetyl-CoA substrate poolê ku ji bedenên ketonê bi gelemperî ve çêbikin, ji ber ku dewletên kêmkirina dermanê carbohydrate, pyruvate di bingeha anaplerosê de, ango, ango-anjîgariya ATP-girêdayî bazarê (OAA), an jî malê (MAL), û ne ku ji acetyl-CoA (oktuel-eta, 2012; Magnusson et al., 1991; Merritt et al, 2011) ne oxuxative oxarativebox. Di liver, glucose û pyruvate de nehêle bi ketogenesisê, tevî ku dema pyruvate decarboxylation bi acetyl-CoA herî zêde ye (Jeoung et al, 2012).
Acetyl-CoA ji hêla aspîleya ATPyê ve ji hêla ATPP'ê veguhestina navîn de hebîtek hepîtal ji hêla ATP'ê ve tête (ew jî lihevhatina întegrasyonê ya metabolîzmê, guhertinên piştî post-guhertin, û fîzîkîolojiya hucrey). Acetyl-COA allosterically Şîrove (i) carboxylase pyruvate (PC), bi vî awayî wesif a mekanîzmaya kontrola maddeyan ku ferz entry anaplerotic yên ji metabolîteyên nav cycle TCA de (Owen et al, 2002;. Scrutton û Utter, 1967) û (ii) pyruvate dehydrogenase kinase, ku fosphorylates û pyruvate dehydrojenase (PDH) (Cooper û al, 1975), bi vî awayî bêtir pêvajoya pyruvate di nav anapleros de bi TCA-ê re derbas dibe. Ji bilî vê, cytoplasmic acetyl-COA, ku pool bi mekanîzmayên ku veguhertina gurcu acetyl-COA bo transportable metabolîteyên tên zêdekirin, inhibits oxidation acid fatty: acetyl-COA carboxylase (ACC) catalyzes ser zivirîna acetyl-COA bo malonyl-COA, li substrate lipogenic û lîberalestiya berbiçav ya CPT1 [li lêkolîn kirin (Kahn et al., 2005; McGarry û Foster, 1980)]. Ji ber vê yekê, du poola mitetondrial-Coetyl-CoA veguherîne û bi rêya rêgeziya kozogenesis, tête ku kîjan alîgirên sereke yên metabolîzma hepatîk.
Fates of Non-Oxidative Metabolic Fates of Ketone
Di çarçoveyek pirzimanî de liver-derived ketones e, ostîdeya SCOT-girêdayî ye. Lê belê, AcAc dikare ji mitochondria veguhastin û bi rêberên anabolic veguherandina rêya AcAc-CoA ji hêla ATT-girêdayî reaksiyonên katalêzedî ji aliyê cytoplasmic acetoacetyl-CoA synthetase (AACS, Fig 1B) ve tê bikaranîn. Ev rêgez di dema pêşveçûnê mêjî de ye û di meydana mammeryayê de (Morris, 2005; Robinson û Williamson, 1978; Ohgami et al., 2003). AACS jî di tissue adipose de tête pejirandin, û osteoclasts çalak kirin (Aguilo et al., 2010; Yamasaki et al., 2016). Cytoplasmic AcAc-CoA dikare ji hêla HMGCS1 ve bi rêberê biosynthesis ve girêdayî ye, an jî ji hêla du cytoplasmîk du sîtollasmîk a acetyl-CoA (ACAA1 û ACAT2), carboxylîteyê bi malonyl-CoA ve tê veşartin, û bi tevliheviya fîdî (Bergstrom et al., 1984; Edmond, 1974; Endemann et al., 1982; Geelen et al., 1983; Webber û Edmond, 1977).
Digel ku girîngiya fîzyolojîkî hîn nehatiye damezrandin, keton dikarin di kezebê de jî wekî substratên anabolîk bixebitin. Di çarçoveyên ceribandinê yên çêkirî de, AcAc dikare bi qasî nîvê lîpîda nû hatî çêkirin, û heya 75% ji kolesterolê nû sentezkirî beşdar bibe (Endemann et al., 1982; Geelen et al., 1983; Freed et al., 1988). Ji ber ku AcAc ji oksîdasyona rûnê ya kezebê ya bêkêmasî tête peyda kirin, şiyana AcAc ku beşdarî lipogenesisê di vivo de bibe tê wateya gerîdeya pûç a kezebê, ku ketonên ji rûn têne hilberandin dikarin ji bo hilberîna lîpîdê werin bikar anîn, têgînek ku girîngiya wê ya fîzyolojîkî pejirandina ceribandinê hewce dike, lê dikare xizmet bike. rolên adapteyî an nebaş (Solinas et al., 2015). AcAc bi dilşewatî kolesterolê peyda dike, bi AACS Km-AcAc (~ 50 �M) kêm dibe sedema çalakkirina AcAc tewra di dewleta fedî de (Bergstrom et al., 1984). Rola dînamîkî ya metabolîzma ketonê ya sîtoplazmî di noyronên embryonîk ên seretayî yên mişkî de û di 3T3-L1-adipocytes de hatî pêşnîyar kirin, ji ber ku têkbirina AACS cûdahiya her celeb hucreyê xera dike (Hasegawa et al., 2012a; Hasegawa et al., 2012). Kêmkirina AACS di mişkan de di vivo de kolesterolê serum kêm kir (Hasegawa et al., 2012c). SREBP-2, rêgezek transkrîpsiyonê ya sereke ya biosenteza kolesterolê, û receptorê aktîfkirî yê proliferatorê peroxisome (PPAR)-? aktîvatorên veguheztinê yên AACS ne, û di dema pêşkeftina neurît û di kezebê de veguheztina wê birêkûpêk dikin (Aguilo et al., 2010; Hasegawa et al., 2012c). Bi hev re, metabolîzma laşê ketonê ya sîtoplazmî dibe ku di şert û mercên hilbijartî an dîroka xwezayî ya nexweşiyê de girîng be, lê ji bo rakirina laşên ketone yên kezebê ne têr in, ji ber ku hîperketonemiya girseyî di cîhana xerabûna bijartî ya çarenûsa oksîdative ya bingehîn de bi windakirina mutasyonên fonksiyonê pêk tê. ji SCOT re (Berry et al., 2001; Cotter et al., 2011).
Qanûna HMGCS2 û SCOT / OXCT1
Di derheqetiya m mitochondrial de ji HMGCS encamên cytosolic ji hêla pêşveçûnê veguhestin, ji ber hewceyê ku hewceyê piştgiriya hepatic ketogenesisê di cûrên bilind de bi mizgeftê re pêdiviya bedena laşê (Boukaftane et al, 1994; Cunnane û Crawford, 2003) bû. Bi xilasiya HMGCS2 bi awayekî mutansiyonên ku di nav mirovan de hizografîk ên hîpogotîkemiya (Pitt et al., 2015, Thompson et al., 1997) têne çêkirin. Gotara HMGCS2 bi hepatocytes û epitheliumê kolonî qedexe ye, û çalakiya xwezayî û enzymatîk bi rêya mekanîzmayên cuda cuda (Mascaro et al, 1995; McGarry û Foster, 1980; Robinson û Williamson, 1980) têne girtin. Dema ku çarçoveyên dewletên fîzîkîolojî bandor dike ku HMGCS2 bandor dike, hewceya wê û îdeolojî û hewceyê hewce dike ku di dema destpêka paşnatalanê de, zûtirîn, diyabetes, birçîbûnê an jî kêşê ketin ketina xwarinê (Balasse û Fery, 1989; Cahill GF Jr, 2006 ; Girard et al., 1992; Hegardt, 1999; Satapati et al., 2012; Sengupta et al., 2010). Di fetusê de, metilasyona herêma 5-alî ya gena Hmgcs2 berevajî bi transkripsiyona wê re têkildar e, û piştî zayînê bi qismî vedigere (Arias et al., 1995; Ayte et al., 1993; Ehara et al., 2015; Ferre et al. ., 1983). Hemî, hepatic Bdh1 di çarçoveyek îdeolojiya pêşveçûna pêşveçûna pêşveçûna pêşveçûnê de, pêşveçûna ji jidayikbûnê re zêde dibe, û ji hêla xwarinê ketogenic di faktora mezinbûnê de (FGF) -21-rexne (Badman et al. 2007; Zhang et al. 1989 ). Di mammalsan de kansogenesis pir bi awayekî însulîn û glucagon bersiv dike, bi awayekî zordestî û berbiçav kirin (McGarry and Foster, 1977). Insulin bi tîrêjê tipolîsê dipeyivîne, bi vî awayî kozogenesis ya xwe veşartî ji ber xwe vegotin, dema ku glucagon bi bandorek rasterast li ser liver (Hegardt, 1999) zêde dibe. Hmgcs2 veguherînek ji hêla faktoriya veguherandina fenivîsê ya FOXA2, ku bi insulin-phosphatidylinositol-3-kinase / Akt tête qedexekirin e, û bi glucagon-cAMP-p300 veguhestinê (Arias et al, 1995; Hegardt, 1999; Hêz û et al. , 1990; Thumelin et al., 1993; von Meyenn et al., 2013; Wolfrum et al., 2004; Wolfrum et al., 2003). PPAR? (Rodriguez et al., 1994) digel armanca xwe, FGF21 (Badman et al., 2007) di heman demê de di dema birçîbûn an rêveberiya parêza ketogenîk de transkripsiyona Hmgcs2 di kezebê de jî çêdike (Badman et al., 2007; Inagaki et al., 2007 ). Destpêkirina PPAR? dibe ku berî derbasbûna ji fetal bo fîzolojiya neonatal çêbibe, dema ku aktîvkirina FGF21 dibe ku di destpêka serdema neonatalê de bi navbeynkariya ?OHB-ya navbeynkar a hîstone deacetylase (HDAC)-3 were xweş kirin (Rando et al., 2016). mTORC1 (armanca mammalan ya kompleksa rapamycin 1) astengkirina girêdayî PPAR? çalakiya transkrîpsiyonê di heman demê de rêgezek bingehîn a îfadeya genê Hmgcs2 ye (Sengupta et al., 2010), û kezeb PER2, oscilatorek çerxa navîn, nerasterast îfadeya Hmgcs2 bi rê ve dibe (Chavan et al., 2016). Çavdêriyên vê dawîyê destnîşan dikin ku interleukin-6-a ku ji tumor-ekstrahepatîk ve hatî çêkirin bi riya PPAR ketogenesis xirab dike? tepisandin (Flint et al., 2016).
HMGCS2 çalakiya enzyme bi rêya PTM-ê ve têne rêve kirin. HMGCS2 serine phosphorylation çalakiya xwe li vîtro (Grimsrud et al., 2012). Çalakiya HMGCS2 ji hêla succinyl-CoA û lîseya nivînên succinylation (Arias et al, 1995; Hegardt, 1999; Lowe û Tubbs, 1985; Qanûna et al., 1990; Rînîn et al., 2013; Reed et al. 1975; Thumelin et al., 1993). Succinylation of HMGCS2, HMGCL, and BDH1-lysine residues in hepek mitochondria hedefên NAD + girêdayî sîgorta 5 (SIRT5) (Rînîn û al., 2013) hedef hebe. Çalakiya HMGCS2 jî ji hêla SIRT3 lysine deacetylasyonê ve zêde dibe, û dikare dibe ku crosstalk di navbera acetylation û succinylation de çalakiya HMGCS2 (Rardin et al., 2013; Şimazu et al., 2013). Tevî ku hêza van PTMs bi rêveberiya HMGCS2 Km û Vmax ve, birêvekirina van PTM ve nehatiye veguherandin û ne ku wekî rêbazên mekanîzmayî yên ketogenesis di vivo de nehatiye pejirandin.
SCOT di her hucreyên mammaliyan de tê nîşandan ku ji mîkochondrayê ve girêdayî ye, ji bilî yên hepatocytes. Giringiya SCOT-çalak û ketolîsê di pêşniyarên SCOT-KO de nîşan kir, ku ji ber ku ji dayika 48h ve tête hîpketonemîk hîperketonemîk hûrgelan de nîşan dide (Cotter et al., 2011). Xeletiya taybetî ya SCOT di neurons û mîkokalên skeletal de nermaleyên metabolîk di dema birçîbûnê de nexşîne lê ne lehal e (Cotter et al., 2013b). Di mirovan de, di jiyana jiyanê de kete ketiacidosyona giran a destpêkê, bi lezgîn, vîdî û coma (Berry et al., 2001; Fukao et al., 2000; Kassovska-Bratinova et al., 1996; Niezen-Koning et al. , 1997; Saudubray et al., 1987; Snyderman et al., 1998; Tildon û Kornblath, 1972). Têkilî piçûk di asta sêwiranê de derbarê der barê SCOT gene û rêbazên xweseriya protein. Dewlet1 MRNA expression û çalakiya SCOT û çalakiyê di nav dewletên ketotic de, dibe ku ji hêla bi rêbazên PPAR-ve girêdayî ye (Fenselau û Wallis, 1974; Fenselau û Wallis, 1976; Grinblat et al., 1986; Okuda et al, 1991; Turko û al ., 2001; Wentz et al., 2010). Di diabetîk ketoacidosyozê de, nermaliya di navbera ketogenesis û hexagonê de bêhehepek bêheheyî de ji sedema kêmbûna astengkirina SCOTê ve bête xistin. Hişyariya însulîn-veguhastina glucose-serbixwe (GLUT1 / SLC2A1) di cardiomyocytes de jî di heman demê de Oxct1 veguhestina gene-anîn û ozîdeyên termînalîn ên di nav ne-ketotic de (an jî Yan û al., 2009) veguherîne. Di liverê, Oxct1 aboriya mRNA ji hêla microRNA-122 û histone mîtîlasyonê H3K27me3 ve tête ku di dema veguhastina fetelê de heta Nesatalê (Thorrez et al, 2011) ve diyar e. Lêbelê, zordariyê ya Oxct1-ê di navnîşana postnatalê de hema sereke ji bo veguhastina Oxct1-hemî hematopoietic vegenitors ji alîgirê veguhastin, ji ber ku ji ber winda kirina Oxct1 ya berê ve di hemî hepatocytes de cudaheng dike. Di rastiyê de, gotina hepatocytes di mîkrojenên Oxct1-MRNA û SCOT-ê de cudahî hepatocytes pir kêm e (Orii et al., 2008).
SCOT jî ji hêla PTM ve tê rêve kirin. Enzîm di mejiyên mişkên SIRT3 KO de hîper-acetîlekirî ye, ku di heman demê de hilberîna acetyl-CoA ya girêdayî AcAc kêmbûyî jî nîşan dide (Dittenhafer-Reed et al., 2015). Nîtrasyona ne-enzîmatîk a bermahiyên tîrosîn ên SCOT di heman demê de çalakiya wê jî kêm dike, ku di dilê modelên cûrbecûr ên mêşên diyabetîk de hatî ragihandin (Marcondes et al., 2001; Turko et al., 2001; Wang et al., 2010a). Berevajî vê, nîtrasyona bermayî ya trîptofanê çalakiya SCOT zêde dike (Br�g�re et al., 2010; Rebrin et al., 2007). Dibe ku mekanîzmayên molekulî yên nîtrasyon an de-nîtasyon-taybetî yên bermayî yên ku ji bo modulkirina çalakiya SCOT hatine çêkirin hebin û hewceyê ronîkirinê bin.
Pevçûnan di Ketogenesis de Extrahepatic
Di memikan de organa ketogenîk a bingehîn kezeb e, û tenê kezeb û şaneyên epîteliya rûvî bi pirranî îzoforma mîtokondrîal ya HMGCS2 îfade dikin (Cotter et al., 2013a; Cotter et al., 2014; McGarry and Foster, 1980; Robinson, 1980 Williamson û 1995) . Fermentasyona bakterî ya anaerobîk a polîsakarîdên tevlihev butîratê dide, ku ji hêla kolonocîtan ve di mammaliyan de ji bo oksîdasyona termînalê an ketogenesisê tê rijandin (Cherbuy et al., 2016), ku dibe ku di cihêrengiya kolonosîtê de rolek bilîze (Wang et al., 2). Ji bilî hucreyên epîtelyal û kezebên rûvî, HMGCS2014 hema hema di hemî şaneyên din ên mammalan de tune ye, lê perspektîfa ketogeneza derveyî kezebê di hucreyên tumor, astrocytes ên pergala nerva navendî, gurçik, pankreas de zêde bûye? hucre, epîteliya rengdêra retînal (RPE), û tewra di masûlkeyên skeletal de (Adijanto et al., 1992; Avogaro et al., 2016; El Azzouny et al., 2016; Grabacka et al., 2015; Kang et al., 2014 Le Foll et al., 2016; Nonaka et al., 2016; Takagi et al., 2016a; Thevenet et al., 2011; Zhang et al., 2). HMGCS2016 ektopîk di tevnên ku kêmasiya kapasîteya ketogenîk a netîceyê de tê dîtin (Cook et al., 2010; Wentz et al., 2), û HMGCS2016 çalakiyên "ronîkirina heyvê"-serbixwe-ketogenesis-a paşerojê nîşan dide, tevî navokê hucreyê (Chen et al. , 2010; Kostiuk et al., 1998; Meertens et al., XNUMX).
Her tevnek ekstrahepatîk ku laşên ketone oksîde dike, di heman demê de potansiyela berhevkirina laşên ketone jî bi riya mekanîzmayên serbixwe yên HMGCS2 heye (Hêjî. 2A). Lêbelê, tevnek der-hepatîk tune ku tê de giraniya laşê ketone ya domdar ji ya di gerokê de derbas dibe (Cotter et al., 2011; Cotter et al., 2013b; Harrison and Long, 1940), destnîşan dike ku laşên ketone li jêr têne veguheztin. gradienta berhevkirinê bi mekanîzmayên girêdayî MCT1/2. Yek mekanîzmayek ketogeneza extrahepatîk a eşkere dibe ku bi rastî zirara têkildar a oksîdasyona ketone nîşan bide. Ravekirinên potansiyel ên pêvek di nav qada damezrandina laşê ketone de ne. Pêşîn, de novo ketogenesis dibe ku bi çalakiya enzîmaya vegerî ya thiolase û SCOT pêk were (Weidemann and Krebs, 1969). Dema ku giraniya acetyl-CoA bi nisbeten bilind e, reaksiyonên ku bi gelemperî ji oksîdasyona AcAc berpirsiyar in berevajî rêve diçin (GOLDMAN, 1954). Mekanîzmayek duyemîn çêdibe dema ku navbeynkarên ?-oksîdasyon ji ber xitimîna çerxa TCA kom dibin, AcAc-CoA di nav reaksiyonê de ku ji hêla 3-hîdroksyacyl-CoA dehydrogenase mitochondrial ve hatî katalîz kirin, û bêtir ji hêla 3-hydroxybutyryl ve vediguhere l-?OHB-CoA. CoA deacylase ji l-?OHB re, ku ji hêla spektrometrîya girseyî an spektroskopiya rezonansê ve ji enantiomera fîzyolojîkî d-?OHB nayê cûda kirin (Reed and Ozand, 1980). l-?OHB dikare bi kromatografî an jî enzîmatîk ji d-?OHB were veqetandin, û di tevnvîsên extrahepatîk de heye, lê ne di kezeb an xwînê de (Hsu et al., 2011). Ketogeneza kezebê tenê d-?OHB hildiberîne, yekane enantiomer ku substratek BDH ye (Ito et al., 1984; Lincoln et al., 1987; Reed and Ozand, 1980; Scofield et al., 1982; Scofield et al., 1982). Sêyemîn mekanîzmayek serbixwe ya HMGCS2 d-?OHB bi katabolîzma asîda amînoyî, nemaze ya leucîn û lîzînê, diafirîne. Mekanîzmayek çaremîn tenê diyar e ji ber ku ew ji ber hunerek nîşankirinê ye û bi vî rengî pseudoketogenesis tê gotin. Ev diyarde ji ber vegerandina reaksiyonên SCOT û thiolase ve girêdayî ye, û dikare bibe sedema zêde texmînkirina zivirandina laşê ketone ji ber kêmbûna îzotopîkî ya şopa laşê ketonê di tevna derveyî kezebê de (Des Rosiers et al., 1990; Fink et al., 1988) . Digel vê yekê, pseudoketogenesis dibe ku di pir rewşan de bêhêz be (Bailey et al., 1990; Keller et al., 1978). Skematîk (Wêne. 2A) rêgezek kêrhatî destnîşan dike ku dema ku balê dikişîne ser giraniya rewşa domdar a ketonan.
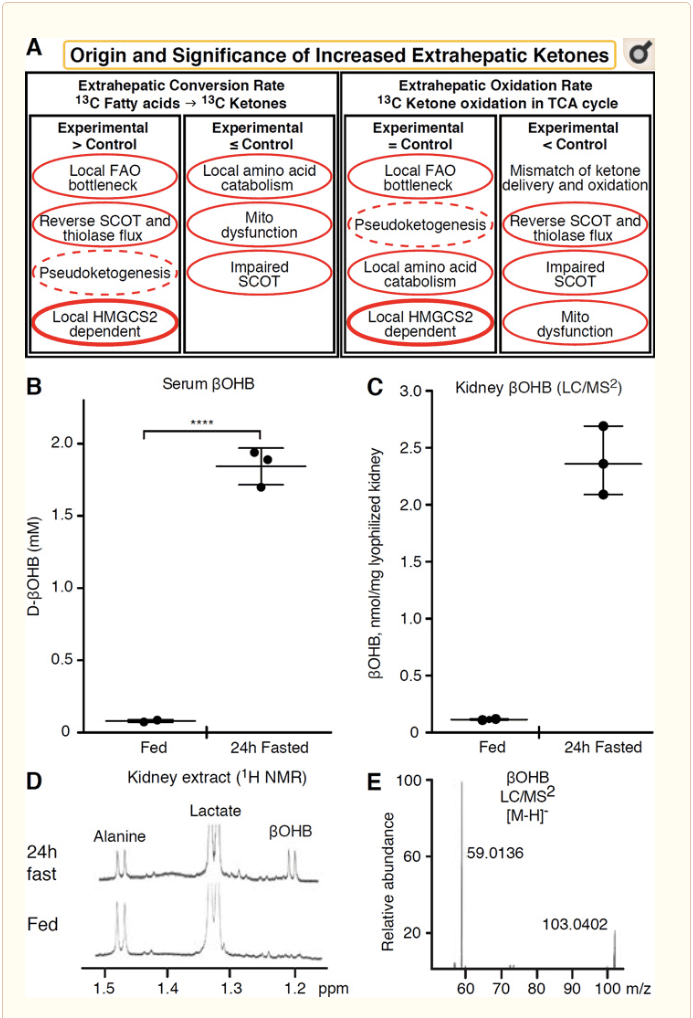

� Gurçik di van demên dawî de wekî organek potansiyel ketogenîk balê dikişîne. Di pirraniya dewletan de, gurçik xerîdarek netîce ya laşên ketone yên kezebê ye, laşên ketone ji xwînê derdixe an vedihewîne, û gurçik bi gelemperî ne hilberîner an berhevkarek laşê ketonê ye (Robinson û Williamson, 1980). Nivîskarên lêkolînek klasîk gihîştin wê encamê ku ketogeneza renal a hindiktirîn ku di pergalek ceribandî ya çêkirî de tê hejmartin ji hêla fîzyolojîkî ve ne têkildar bû (Weidemann û Krebs, 1969). Di van demên dawî de, ketogeneza gurçikê di modelên mişkê yên kêmasiya diyabetîk û otofajiyê de hate destnîşan kirin, lê îhtîmal e ku veguheztinên pir-organan ên di homeostaza metabolîk de metabolîzma ketonê ya entegre bi navgîniya têketinên li ser gelek organan biguhezînin (Takagi et al., 2016a; Takagi et al., 2016b; Zhang et al., 2011). Yek weşanek vê dawîyê ketogeneza gurçikê wekî mekanîzmayek parastinê li dijî birîna ishemi-reperfuzyonê ya di gurçikê de pêşniyar kir (Tran et al., 2016). Pîvana bêkêmasî ya domdar a ?OHB ji derhênerên tevna gurçikê ya mişkan di ~4~12 mM de hate ragihandin. Ji bo ku em biceribînin ka ev maqûl e, me hûrgelên ?OHB yên di ekstraktên gurçikê yên mêşên têrkirî û 24 saetan de rojî girtine da hejmartin. Giraniya ?OHB di serumê de ji ~ 100 �M bo 2 mM bi rojiya 24 saetan re zêde bû (Hêl. 2B), di heman demê de ku giraniya ?OHB ya rewşa domdar a gurçikê di rewşa fedîkirinê de nêzî 100 �MM, û di rewşa rojiyê ya 1 saetan de tenê 24 mM ye (Hêl. 2C�E), çavdêriyên ku bi hejmûnên 45 sal berê hatine hejmartin re hevaheng in (Hems û Brosnan, 1970). Mimkun e ku di dewletên ketotîk de, laşên ketone yên kezebê dikarin ji nû ve parastinê bikin, lê delîlên ji bo ketogenesiza gurçikê hewceyê bêtir rastdariyê hewce dike. Delîlên berbiçav ên ku ketogeneza extrahepatîk a rastîn piştgirî dike di RPE de hate pêşkêş kirin (Adijanto et al., 2014). Ev veguherîna metabolîk a balkêş hate pêşniyar kirin ku bi potansiyel rê bide ketonên ku ji RPE-yê hatine wergirtin biherikin şaneyên glia yên fotoreceptor an M�ller, ku dikarin di nûvekirina beşa derveyî ya fotoreceptorê de bibin alîkar.
?OHB wek navbeynkarê sînyalê
Her çend ew ji hêla enerjîk ve dewlemend in, laşên ketone di homeostaza hucreyî de rolên îşaretê yên "ne-kanonîkî" provokatîf dikin (Wêne. 3) (Newman and Verdin, 2014; Rojas-Morales et al., 2016). Mînakî, ?OHB HDACên Klasa I asteng dike, ku acetilasyona hîstone zêde dike û bi vî rengî vegotina genên ku stresa oksîdatîf kêm dike çêdike (Shimazu et al., 2013). ?OHB bi xwe di bermahiyên lîzînê de di kezeba mêşên diyabetîk ên bi rojî an streptozotosîn de guhezkerek kovalentek hîstone ye (Xie et al., 2016) (li jêr jî binêre, Yekbûna metabolîzma laşê ketone, guherîna piştî-wergerandinê, û fîzolojiya hucreyê, û Laşên Ketone, stresa oksîdative, û neuroprotection).
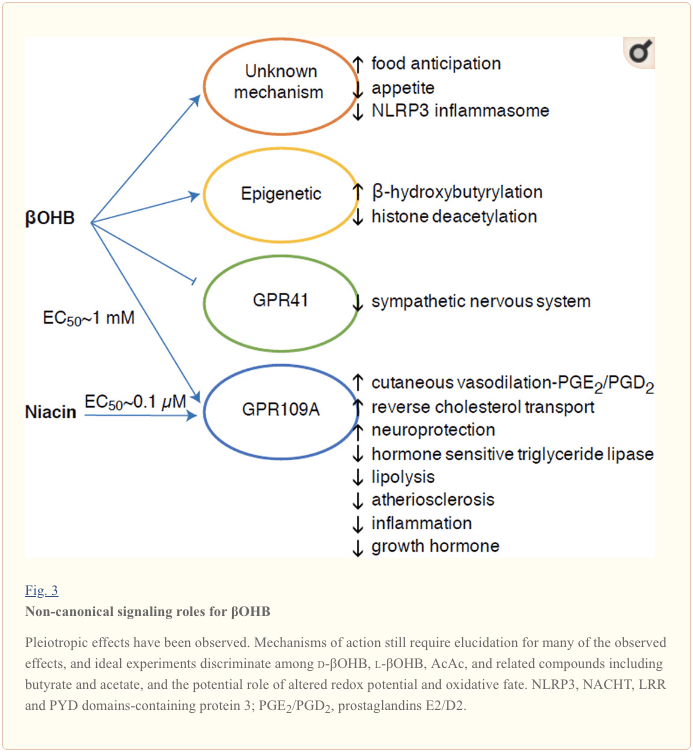
?OHB di heman demê de bi receptorên bi proteîn-G ve bandorker e. Bi navgîniya mekanîzmayên molekulî yên ne diyar, ew çalakiya pergala nerva sempatîk ditepisîne û xerckirina enerjiyê ya tevahî û rêjeya dil kêm dike bi astengkirina nîşana asîda rûnê ya zincîra kurt bi navgîniya receptorê bi proteîna G 41 (GPR41) (Kimura et al., 2011). Yek ji bandorên îşaretkirinê yên herî lêkolînkirî yên ?OHB bi navgîniya GPR109A (ku wekî HCAR2 jî tê zanîn), endamek ji bin-malbata asîda hîdrokarboksîlîk GPCR ku di tevnên qelew (spî û qehweyî) de tê diyar kirin (Tunaru et al., 2003) derbas dibe (Tunaru et al., 2009). hucreyên parastinê (Ahmed et al., 109). ?OHB yekane lîganda endojen a naskirî ya receptora GPR50A ye (EC770 ~ 2005 �M) ku ji hêla d-?OHB, l-?OHB, û butyrate ve tê çalak kirin, lê ne AcAc (Taggart et al., 109). Rêjeya giraniya bilind a ji bo aktîvkirina GPR109A bi girêdana parêzek ketogenîk, birçîbûn, an di dema ketoacidosis de tête bidestxistin, ku rê li ber astengkirina lîpolîzasyona tevna adipose digire. Bandora antî-lîpolîtîk a GPR2009A bi astengkirina adenylyl cyclase û kêmkirina cAMP, astengkirina lîpaza trîglîserîd a hestiyar a hormonê pêşve diçe (Ahmed et al., 2003; Tunaru et al., 2009). Ev dorvegerek negatîf diafirîne ku tê de ketosis bi kêmkirina berdana asîdên rûnê yên ne-esterîfkirî yên ji adipocytes (Ahmed et al., 2005; Taggart et al., 3) frenek modulator li ser ketogenezê dixe. ajotina sempatîk ku lîpolîzê teşwîq dike. Niacin (vîtamîn B50, asîda nîkotînîk) ji bo GRP0.1A lîgandek bi hêz (EC109 ~ 2005 �M) ye, bi dehsalan bi bandor ji bo dyslipidemias tê bikar anîn (Benyo et al., 2006; Benyo et al., 2010; Fabbrini ;a,2011 et. Lukasova et al., 2003; Tunaru et al., 2011). Dema ku niacin veguheztina kolesterolê ya berevajî di makrofajan de zêde dike û birînên atherosklerotîk kêm dike (Lukasova et al., 109), bandorên ?OHB li ser birînên atherosklerotîk nayê zanîn. Her çend receptorê GPR2015A rolên parastinê dixebitîne, û têkiliyên balkêş di navbera karanîna parêza ketogenîk de di stroke û nexweşiyên neurodejenerative de hene (Fu et al., 2014; Rahman et al., 109), rola parastinê ya ?OHB bi GPRXNUMXA di vivo de nehatiye xuyang kirin. .
Di dawiyê de, ?OHB dibe ku bandorê li xwarin û têrbûnê bike. Meta-analîzek lêkolînên ku bandorên parêzên ketogenîk û pir kêm enerjiyê dipîvin encam da ku beşdarên ku van parêzan vedixwin, li gorî parêzên kontrolê têrbûnek bilindtir nîşan didin (Gibson et al., 2015). Lêbelê, ravekirinek maqûl ji bo vê bandorê hêmanên metabolîk an hormonal ên zêde ye ku dibe ku guhê xwe biguhezîne. Mînakî, mêşên ku li ser parêzek ketogenîk a rodent têne domandin, lêçûnên enerjiyê li gorî mêşên ku bi kontrol-xwarinê têne xwarin zêde nîşan didin, tevî girtina kalorîkî ya wekhev, û leptîn an genên peptîdên ku tevgera xwarinê birêkûpêk dikin nayên guhertin (Kennedy et al., 2007). Di nav mekanîzmayên pêşniyarkirî de yên ku ji hêla ?OHB ve tepeserkirina şêtbûnê pêşniyar dikin de hem nîşankirin û hem jî oksîdasyon heye (Laeger et al., 2010). Jêbirina taybetî ya kezebê ya genê rîtma circadian (Per2)-û lêkolînên immunoprecipitation kromatin diyar kir ku PER2 rasterast gena Cpt1a çalak dike, û nerasterast Hmgcs2 birêkûpêk dike, ku di mêşên Per2 nockout de dibe sedema ketosisê astengdar (Chavan 2016, 2014). Van mişkan bendewariya xwarinê ya astengdar nîşan dan, ku ji hêla rêveberiya ?OHB-a pergalî ve qismî hate sererast kirin. Lêkolînên paşerojê dê hewce bibin ku pergala nerva navendî wekî hedefek rasterast a ?OHB were piştrast kirin, û gelo ji bo bandorên çavdêrîkirî oksîdasyona ketone hewce ye, an jî mekanîzmayek din a îşaretkirinê têkildar e. Lêkolînerên din îhtîmala ketogenesis-astrocyte-derketî ya herêmî di hundurê hîpotalamusa ventromedial de wekî rêgezek girtina xwarinê gazî kirine, lê van çavdêriyên pêşîn jî dê ji nirxandinên genetîk û fluksê sûd werbigirin (Le Foll et al., XNUMX). Têkiliya di navbera ketosis û bêparbûna xurekê de ji berjewendiyê dimîne ji ber ku birçîbûn û têrbûn hêmanên girîng in di hewildanên têkçûyî yên windakirina giran de.
Yekbûyî ya Metabolîzmê ya Ketone, Guhertina Post-Translasyon, û Fîzolojiya Cell
Dezgehên Ketone ji bo hewlên acetyl-CoA, yekîneyeke sereke yên ku li metabolîzma hucreyî (Pietrocola et al, 2015) nîşan dide. Yek ji rola acetyl-CoA e ku ji bo acetylasyonê, an guhartina enzymîly-catalyzed hîstone-kewalent (Choudhary et al., 2014; Dutta et al., 2016; Fan et al., 2015; Menzies et al., 2016 ). Gelek hejmara proteîneyên mitochondrial dînokondîdî, piraniya ku dibe ku bi rêbazên ne-enzymaticî têne çêkirin, ji hêla lêkolînên proteomîk ên dittenhafer-Reed et al., 2015; Hebert et al., 2013; Rardin et al. 2013 ; Shimazu et al., 2010). Lysine deacetylases bikar anîn zinc cofactor (mînak, HDACs nucleocytosolic) an jî NAD + wek hev-substrate (şewitandin, SIRTs) (Choudhary et al, 2014; Menzies et al, 2016). Acetylproteome wekî hemî sensor û bandorê ya hemî acetyl-CoA-êlekê ya hucreyê, wekî pisporên fizîkî û genetîkî hemî encamên guhertinên cîhanî yên navneteweyî (Weinert et al., 2014). Wekî ku metabolîteyên intracellular wekî xizmetkarên lîberînê yên akîtîlasyonê xizm dikin, ew girîng e ku rola kargehên ketone, ku pir zêde pir dînamîk e.
?OHB bi kêmanî bi du mekanîzmayan ve guherbarek epîgenetîk e. Zêdebûna astên ?OHB yên ku bi rojîgirtinê, sînorkirina kaloriyê, rêveberiya rasterast an werzîşê ya dirêj ve hatî çêkirin, astengkirina HDAC an aktîvkirina hîstone acetyltransferase provoke dike (Marosi et al., 2016; Sleiman et al., 2016) an jî stresa oksîdative (Shimazu et al., 2013) . Astengkirina ?OHB ya HDAC3 dikare fîzyolojiya metabolîk a nûbûyî bi rê ve bibe (Rando et al., 2016). Serbixwe, ?OHB bixwe rasterast bermahiyên lîzîna hîstone diguhezîne (Xie et al., 2016). Rojiya dirêj, an ketoasîdoza diyabetîk a ku ji hêla steptozotocin ve hatî çêkirin, ?-hydroxybutyrylasyona hîstone zêde kir. Her çend hejmara cihên lîzînê ?-hîdroksîbutyrylasyon û acetilasyonê berawirdî bû jî, ji hêla stoichiometrical ve ji acetilasyonê mezintir ?-hîdroksîbutyrylasyona hîstone hate dîtin. Genên cihêreng ji hêla hîstone lysine ?-hydroxybutyrylation, li hember acetylation an methylation ve hatin bandor kirin, ku fonksiyonên hucreyî yên cihêreng pêşniyar dike. Nayê zanîn ku ?-hîdroksîbutyrylasyon spontan e an enzîmatîk e, lê bi navgîniya laşên ketone ve rêza mekanîzmayan berfireh dike ku bi dînamîk bandorê li transkripsiyonê dike.
Bûyerên ji nû ve bernamesazkirina hucreyê yên bingehîn ên di dema sînorkirina kaloriyê û bêparkirina xurekê de dibe ku bi rêzê ve di deacetilasyon û desuccinylation mîtokondrîal ên girêdayî SIRT3- û SIRT5-ê de werin navber kirin, ku proteînên ketogenîk û ketolîtîk di asta piştî-wergerandinê de di kezeb û tevnên derveyî kezebê de birêkûpêk bikin (Dittenethafer, Reed al. 2015; Hebert et al., 2013; Rardin et al., 2013; Shimazu et al., 2010). Her çend berhevoka stokyometrîkî ya deverên dagirkirî ne hewce ye ku rasterast bi veguheztinên di herikîna metabolîk de ve girêdayî be jî, acetilasyona mitokondrî dînamîk e û dibe ku ji hêla acetyl-CoA an pH-ya mîtokondrî ve were rêve kirin, ji bilî acetyltransferases enzîmatîk (Wagner and Payne, 2013). Ku SIRT3 û SIRT5 çalakiyên enzîmên metabolîzasyona laşê ketone modul dikin, pirsa rola berevajî ya ketoneyan di peykerkirina acetilproteome, succinylproteome, û armancên din ên hucreyî yên dînamîkî de vedigire. Bi rastî, ji ber ku cûrbecûrên ketogenesis hûrguliyên NAD + nîşan dide, hilberîna ketone û pirbûna dikare çalakiya sirtuin rêve bike, bi vî rengî bandorê li hewzên acetil-CoA/succinyl-CoA, acylproteome, û bi vî rengî fîzyolojiya mîtokondrîal û hucreyê bike. ?-hîdroksîbutyrylkirina bermahiyên enzîma lîzînê dikare qatek din li ji nûvebernamekirina şaneyê zêde bike. Di tevnvîsên extrahepatîk de, oksîdasyona laşê ketone dibe ku guhertinên analogî di homeostaza hucreyê de teşwîq bike. Digel ku dabeşkirina hewzên acetyl-CoA pir bi rêkûpêk e û speklek berfireh a guheztinên hucreyî koordîne dike, şiyana laşên ketone ku rasterast hem mîtokondrî û hem jî pîvazên acetyl-CoA yên sîtoplazmîk çêdikin hewceyê ronîkirinê ye (Chen et al., 2012; Corbet et al., 2016; Pougovkina et al., 2014; Schwer et al., 2009; Wellen and Thompson, 2012). Ji ber ku hûrgelên acetyl-CoA bi hişk têne rêve kirin, û acetyl-CoA bêserûberî membran e, girîng e ku meriv mekanîzmayên ajokerê ku homeostaza acetyl-CoA hevrêz dike, di nav de rêjeyên hilberînê û oksîdasyona termînalê di çerxa TCA de, veguheztina laşên ketone, mîtokondrial, were hesibandin. fluks bi karnitine acetyltransferase (CrAT), an acetyl-CoA hinardekirina sîtosolê piştî veguheztina sitrate û berdana ji hêla ATP citrate lyase (ACLY). Rolên sereke yên van mekanîzmayên paşîn di acetilproteom û homeostasisê de hewce dike ku têgihîştina hevgirtî ya rolên ketogenesis û oksîdasyona ketonê (Das et al., 2015; McDonnell et al., 2016; Moussaieff et al., 2015; Overmyer et al., 2015; 2014; Seiler et al., 2015; Seiler et al., 2009; Wellen et al., 2012; Wellen û Thompson, XNUMX). Teknolojiyên lihevhatî yên di metabolomics û acylproteomics de di mîhengên modelên bi genetîkî têne manipulandin de dê hewce bibin ku armanc û encaman diyar bikin.
Bersivên Ant-û-Inflammatory to Ketone Bikin
Ketosis û laşên ketone iltîhaba û fonksiyona hucreya berevaniyê modul dikin, lê mekanîzmayên cûrbecûr û hetta ferq jî hatine pêşniyar kirin. Dûrbûna demdirêj a xwarinê iltîhaba kêm dike (Youm et al., 2015), lê ketoza kronîk a şekir 1 rewşek pro-înflamatuar e (Jain et al., 2002; Kanikarla-Marie and Jain, 2015; Kurepa et al., 2012 ). Di iltîhaba ?OHB-ê de rolên sînyalan-bingeha mekanîzmê derdikevin holê ji ber ku gelek hucreyên pergala berevaniyê, tevî makrofage an monocytes, bi berfirehî GPR109A diyar dikin. Dema ku ?OHB bi giranî bersivek dijî-înflamatuar pêk tîne (Fu et al., 2014; Gambhir et al., 2012; Rahman et al., 2014; Youm et al., 2015); bersivek pro-înflamatuar derxe (Jain et al., 2002; Kanikarla-Marie and Jain, 2015; Kurepa et al., 2012).
Rolên dijî-înflamatuar ên lîgandên GPR109A di atherosclerosis, qelewbûn, nexweşiya ziravî, nexweşiya neurolojîk, û kanserê de hatine vekolîn (Graff et al., 2016). Gotina GPR109A di hucreyên RPE yên modelên diyabetîk, nexweşên diyabetîk ên mirovî (Gambhir et al., 2012), û di mîkroglia de di dema neurodejenerasyonê de zêde dibe (Fu et al., 2014). Bandorên dijî-înflamatuar ên ?OHB bi zêdebûna GPR109A di hucreyên RPE de têne zêdekirin, û ji hêla astengkirina dermankolojîkî an qutkirina genetîkî ya GPR109A ve têne betal kirin (Gambhir et al., 2012). ?OHB û asîda nîkotînîk a exogenous (Taggart et al., 2005), her du jî di TNF de bandorên dijî-înflamatuar didin? an iltîhaba ku ji hêla LPS ve hatî çêkirin bi kêmkirina astên proteînên pro-înflamatuar (iNOS, COX-2), an sîtokînên veşartî (TNF?, IL-1?, IL-6, CCL2/MCP-1), beşek ji hêla astengkirina NF-ê ve. -?B veguherîn (Fu et al., 2014; Gambhir et al., 2012). ?OHB stresa ER û înflamazoma NLRP3 kêm dike, bersiva stresê ya antîoksîdan çalak dike (Bae et al., 2016; Youm et al., 2015). Lêbelê, di iltîhaba neurodejeneratîf de, parastina bi navbeynkariya ?OHB-girêdayî GPR109A navbeynkarên înflamatuar ên mîna nîşana rêça MAPK-ê (mînak, ERK, JNK, p38) nagire (Fu et al., 2014), lê dibe ku hewce bike PGD1-girêdayî COX-2. berhem (Rahman et al., 2014). Balkêş e ku macrofage GPR109A hewce ye ku bandorek neuroprotektîf bike di modela derbeya iskemîk de (Rahman et al., 2014), lê şiyana ?OHB ku înflamazoma NLRP3 di makrofajên ji mêjûya hestî de asteng bike GPR109A serbixwe ye (Hûn ., 2015). Her çend piraniya lêkolînan ?OHB bi bandorên dij-înflamatuar ve girêdidin, ?OHB dibe ku pro-înflamatuar be û nîşankerên peroksîdana lîpîdê di kezebên golikan de zêde bike (Shi et al., 2014). Ji ber vê yekê bandorên dijî-înflamatuar ên ?OHB-ê dibe ku bi celebê şaneyê, giraniya ?OHB, dirêjahiya vegirtinê, û hebûn an nebûna hev-modulatoran ve girêdayî be.
Berevajî ?OHB, AcAc dibe ku sînyala pro-înflamatuar çalak bike. AcAc bilindkirî, nemaze bi giraniya glukozê ya bilind, birînek hucreya endotelîal bi navgîniya mekanîzmayek girêdayî NADPH oxidase / stresê oksîdative xurt dike (Kanikarla-Marie and Jain, 2015). Girêdanên AcAc yên bilind ên di bejna neftê ya dayikên diyabetîk de bi rêjeya oksîdasyona proteînê ya bilind û giraniya MCP-1 re têkildar bûn (Kurepa et al., 2012). AcAc bilind di nexweşên diyabetîk de bi TNF re têkildar bû? îfade (Jain et al., 2002), û AcAc, lê ne ?OHB, TNF?, îfadeya MCP-1, kombûna ROS, û asta cAMP-ê di hucreyên monocyte mirovan U937 de kêm kir (Jain et al., 2002; Kurepa et al. ., 2012).
Fenomenên îşaretkirinê yên girêdayî laşê ketonê bi gelemperî tenê bi tansiyonên laşê ketone yên bilind (> 5 mM) têne destnîşan kirin, û di rewşa gelek lêkolînan de ku ketone bi bandorên pro- an dijî-înflamatuar ve, bi mekanîzmayên ne diyar ve girêdide. Wekî din, ji ber bandorên nakok ên ?OHB beramberî AcAc li ser iltîhaba, û şiyana rêjeya AcAc/?OHB ku bandorê li potansiyela redoksa mitokondrî bike, ceribandinên çêtirîn ku rola laşên ketone yên li ser fenotîpên hucreyî dinirxînin, bandorên AcAc û ? OHB di rêjeyên cûrbecûr de, û di hûrgelên berhevkirî yên cihêreng de [mînak, (Saito et al., 2016)]. Di dawiyê de, AcAc dikare ji hêla bazirganî ve tenê wekî xwêyek lîtium an jî wekî etîl esterek ku berî karanîna hîdrolîza bingehîn hewce dike were kirîn. Kationê lîtiumê serbixwe kaskadên veguheztina sînyalê çêdike (Manji et al., 1995), û AcAc anion lal e. Di dawiyê de, lêkolînên ku bi d/l-?OHB racemîk bikar tînin dikarin werin tevlihev kirin, ji ber ku tenê stereoizomera d-?OHB dikare ji AcAc re were oksîd kirin, lê d-?OHB û l-?OHB dikarin her yek bi GPR109A nîşan bidin, înflamazoma NLRP3 asteng bikin. û wekî substratên lipojenîk xizmet dikin.
Çavkaniyên Ketone, Stressed Oxxative, û Neuroprotîkê
Stresa oksîdatîf bi gelemperî wekî rewşek tê pênase kirin ku tê de ROS zêde têne pêşkêş kirin, ji ber hilberîna zêde û / an jêbirina astengdar. Rolên kêmkirina stresê antîoksîdan û oksîdative yên laşên ketone bi berfirehî hem in vitro û hem jî di vivo de, nemaze di çarçoveya neuroparastinê de, hatine vegotin. Ji ber ku piraniya neuron bi bandor fosfatên bi enerjiya bilind ji asîdên rûn naafirînin, lê dema ku karbohîdartan kêm in, laşên ketone oksîd dikin, bandorên neuroparastî yên laşên ketone bi taybetî girîng in (Cahill GF Jr, 2006; Edmond et al., 1987; Yang et al., 1987). Di modelên stresa oksîdatîf de, vegirtina BDH1 û tepeserkirina SCOT pêşniyar dike ku metabolîzma laşê ketone dikare ji nû ve were bernamekirin da ku nîşana hucreyê ya cihêreng, potansiyela redox, an hewcedariyên metabolê bidomîne (Nagao et al., 2016; Tieu et al., 2003).
Laşên ketonî di neuron û cardiomyocytes de astên zirara hucreyî, birîn, mirin û apoptoza jêrîn kêm dikin (Haces et al., 2008; Maalouf et al., 2007; Nagao et al., 2016; Tieu et al., 2003). Mekanîzmayên gazîkirî cihêreng in û ne her gav bi xêzikî ve girêdayî ne. Giraniyên mîlîmolar ên kêm ên (d an l)-?OHB ROS (anion hîdroksîl) hildiweşîne, dema ku AcAc gelek celebên ROS-ê diparêze, lê tenê di hûrgelên ku ji rêza fîzyolojîkî (IC50 20-67 mM) derbas dibin (Haces et al., 2008) . Berevajî vê, bandorek bikêr li ser potansiyela redoxê ya zincîra veguheztina elektronê mekanîzmayek e ku bi gelemperî bi d-?OHB ve girêdayî ye. Dema ku her sê laşên ketone (d/l-?OHB û AcAc) mirina hucreya neuronal û berhevkirina ROS-ê ya ku ji hêla astengkirina kîmyewî ya glycolîzê ve hatî destpêkirin kêm kir, tenê d-?OHB û AcAc pêşî li kêmbûna ATP ya neuronal girt. Berevajî vê, di modelek di vivo de hîpoglycemîk de, (d an l) -?OHB, lê ne AcAc pêşî li peroksîdana lîpîdê hippocampal girt (Haces et al., 2008; Maalouf et al., 2007; Marosi et al., 2016; Murphy, 2009 Tieu et al., 2003). Vekolînên in vivo yên mişkên ku bi parêzek ketogenîk (87% rûn kcal û 13% proteîn) hatine xwarin, guhertoya neuroanatomîkî ya kapasîteya antîoksîdan nîşan da (Ziegler et al., 2003), ku li wir guherînên herî kûr di hîpokampûsê de, bi zêdebûna glutathione peroxidase û tevahî re, hatine dîtin. kapasîteyên antîoksîdan.
Xwarina ketojenîk, esterên ketonê (di heman demê de binihêrin Bikaranîna dermankirinê ya parêza ketogenîk û laşên keton ên biyanî), an rêveberiya ?OHB di modelên strokeya iskemîk de neuroparastinê dike (Rahman et al., 2014); Nexweşiya Parkinson (Tieu et al., 2003); Girtina jehra oksîjenê ya pergala nerva navendî (D'Agostino et al., 2013); spazmayên epîleptîk (Yum et al., 2015); encefalomîopatiya mitokondrî, asîdoza laktîk û sendroma serpêhatiyên mîna stroke (MELAS) (Frey et al., 2016) û nexweşiya Alzheimer (Cunnane and Crawford, 2003; Yin et al., 2016). Berevajî vê, raporek vê dawîyê delîlên histopatolojîkî yên pêşkeftina neurodejenerative ji hêla parêzek ketogenîk ve di modelek mişkek transgenîkî ya tamîrkirina DNA ya mîtokondrî ya nenormal de, tevî zêdebûna biyojeneya mîtokondrîal û nîşaneyên antîoksîdan nîşan da (Lauritzen et al., 2016). Raporên din ên nakokî destnîşan dikin ku rûbirûbûna bi giraniya laşê ketone ya bilind stresê oksîdative derdixe holê. Dozên bilind ên ?OHB an AcAc di kezebên golikan de derxistina oksîda nîtrîk, peroksîda lîpîdê, kêmbûna îfadeya SOD, glutathione peroxidase û katalazê dihejîne, dema ku di kezebên mişkê de înduksiona rêça MAPK ji AcAc re tê veqetandin lê ne ?OHB (Abdelmegeed 2004, et al. Shi et al., 2014; Shi et al., 2016).
Bi hev re, pir rapor ?OHB bi kêmbûna stresa oksîdatîf ve girêdidin, ji ber ku rêveberiya wê hilberîna ROS/superoksîtê asteng dike, pêşî li peroksîdankirina lîpîdê û oksîdasyona proteînê digire, asta proteîna antîoksîdan zêde dike, û hilma mîtokondrîal û hilberîna ATP çêtir dike (Abdelmegeed et al., 2004; Haces et al., 2008; Jain et al., 1998; Jain et al., 2002; Kanikarla-Marie and Jain, 2015; Maalouf et al., 2007; Maalouf and Rho, 2008; Marosi et al., 2016; et al., 2003; Yin et al., 2016; Ziegler et al., 2003). Dema ku AcAc rasterast ji ?OHB-ê bi vegirtina stresa oksîdative re têkildar e, ev bandor her gav bi hêsanî ji bersivên pro-înflamatuar ên paşerojê nayên veqetandin (Jain et al., 2002; Kanikarla-Marie and Jain, 2015; Kanikarla-Marie û Jain, 2016). Digel vê yekê, girîng e ku meriv zanibe ku feyda antîoksîdan a diyar a ku ji hêla parêzên ketogenîk ên pleiotropîk ve hatî peyda kirin dibe ku ji hêla laşên ketone bixwe ve neyê veguheztin, û neuroparastina ku ji hêla laşên ketone ve hatî peyda kirin dibe ku bi tevahî ji stresa oksîdatîf neyê veguheztin. Mînakî di dema bêparbûna glukozê de, di modelek kêmbûna glukozê ya di noyronên kortik de, ?OHB herikîna otofajîk teşwîq kir û pêşî li kombûna otofagozomê girt, ku bi kêmbûna mirina neuronal re têkildar bû (Camberos-Luna et al., 2016). d-?OHB di heman demê de proteînên antîoksîdan ên kanonîkî FOXO3a, SOD, MnSOD, û katalase jî çêdike, bi paşerojê ve bi astengkirina HDAC (Nagao et al., 2016; Shimazu et al., 2013).
Nexweşiya Gelek Nexşîkî (NAFLD) û Metabolîzmê ya Ketone
NAFLD-ê qelew-girêdayîn û steatohepatîta bê alkol (NASH) sedemên herî gelemperî yên nexweşiya kezebê li welatên Rojavayî ne (Rinella and Sanyal, 2016), û têkçûna kezebê ya ku ji hêla NASH ve hatî çêkirin yek ji sedemên herî hevpar a veguhastina kezebê ye. Gava ku depokirina zêde ya triacylglycerols di hepatocytes> 5% giraniya kezebê (NAFL) bi tenê nabe sedema fonksiyona kezeba dejeneratif, pêşveçûna NAFLD di mirovan de bi berxwedana însulîn a sîstematîkî û zêdebûna rîska diyabeta 2-ê re têkildar dibe, û dibe ku bibe sedema pathogenesis of nexweşiya dil û nexweşîya gurçik a kronîk (Fabbrini et al., 2009; Targher et al., 2010; Targher and Byrne, 2013). Mekanîzmayên pathojenîk ên NAFLD û NASH bi tevahî nayê fam kirin lê di nav de anormalîzmayên metabolîzma hepatocît, xweseriya hepatocît û stresa retikûlûma endoplazmî, fonksiyona şaneya parastinê ya hepatîk, iltîhaba tevna adipose, û navbeynkarên înflamatîk ên sîstematîkî hene (Fabbrini et al., 2009; Masuoka û Chalasani, 2013 ; Targher û yên din, 2010; Yang û yên din, 2010). Pergalên karbohîdartan, lîpîd, û metabolîzma amîno asîd di mirovan de û di organîzmayên model de qelewbûn, şekir, û NAFLD çêdibe û dibe alîkar [li (Farese et al., 2012; Lin û Accili, 2011; Newgard, 2012; Samuel û Shulman, 2012; Roj û Lazar, 2013)]. Dema ku anormaliyên hepatocîtê di metabolîzma lîpîdê ya sîtoplazmî de bi gelemperî di NAFLD de têne dîtin (Fabbrini et al., 2010b), rola metabolîzma mitokondrî, ya ku îstîsmarkirina oksîda rûnan di rêveberiya NAFLD de kêmtir eşkere ye. Anormalîzmayên metabolîzma mitokondrî di NAFLD / NASH patogjenîzasyonê de çêdibin û dibin alîkar (Hyotylainen et al., 2016; Serviddio et al., 2011; Serviddio et al., 2008; Wei et al., 2008). General heye (Felig et al., 1974; Iozzo et al., 2010; Koliaki et al., 2015; Satapati et al., 2015; Satapati et al., 2012; Sunny et al., 2011) lê ne yeksan ( Koliaki and Roden, 2013; Perry et al., 2016; Rector et al., 2010) lihevhatin ku, berî pêşkeftina NASH ya dilsoz, oksîdasyona mîtokondrî ya hepatîk, û bi taybetî oksîdasyona rûn, di qelewbûnê de, berxwedana însulîna pergalê tête zêdekirin , û NAFLD. Htîmal e ku her ku NAFLD pêşve here, heterojeniya oksîdatîf, di nav mitokondriyên takekesî de jî, derdikeve holê, û di dawiyê de fonksiyona oksîdatîf xera dibe (Koliaki et al., 2015; Rector et al., 2010; Satapati et al., 2008; Satapati et al ., 2012).
Ketogenesis bi gelemperî wekî proxy ji bo oksîdasyona rûnê kezebê tê bikar anîn. Astengiyên ketogenesis her ku NAFLD di modelên heywanan de, û dibe ku di mirovan de pêşve diçe, derdikevin holê. Bi mekanîzmayên bêkêmasî diyarkirî, hîperînsulînemia ketogenezê ditepisîne, dibe ku li gorî kontrolên bêhêz beşdarî hîpoketonemiyê bibe (Bergman et al., 2007; Bickerton et al., 2008; Satapati et al., 2012; Soeters 2009 et al. , 2011; Cîgirê et al., 2005). Digel vê yekê, şiyana gerîdeyên laşê ketonê ku pêşbîniya NAFLD-ê dike nakokî ye (Mânnist et al., 2015; Sanyal et al., 2001). Rêbazên spektroskopî yên rezonansa magnetîkî yên jimarî yên bihêz di modelên heywanan de rêjeya veguheztina ketonê bi berxwedana însulînê ya nerm re eşkere kir, lê rêjeyên kêmbûyî bi berxwedana însulînê ya tundtir diyar bûn (Satapati et al., 2012; Sunny et al., 2010). Di mirovên qelew ên bi kezeba qelew de, rêjeya ketogenîk normal e (Bickerton et al., 2008; Sunny et al., 2011), û ji ber vê yekê, rêjeyên ketogenesis bi zêdebûna barkirina asîda rûnê di hundurê hepatocîtan de kêm dibin. Ji ber vê yekê, acetyl-CoA-ya ku ji ?-oksîdasyonê hatî hilberandin dibe ku di çerxa TCA de berbi oksîdasyona termînalê ve were rêve kirin, oksîdasyona termînalê zêde bike, glukoneogenesis-fosphoenolpyruvate-rêveber bi riya anaplerosî/cataplerosis, û stresa oksîtasyonê zêde bike. Acetyl-CoA di heman demê de dibe ku ji mitochondria wekî sitrate, substratek pêşîn a lipogenesisê (Hêjî. 4) hinarde bike (Satapati et al., 2015; Satapati et al., 2012; Solinas et al., 2015). Dema ku ketogenesis ji însulînê an rojiyê re bi qelewbûna dirêjtir re kêmtir dibe (Satapati et al., 2012), mekanîzmayên bingehîn û encamên jêrîn ên vê yekê bi tevahî têne fêm kirin. Delîlên dawî destnîşan dikin ku mTORC1 ketogenezê bi rengekî ku dibe ku li jêr îşaretkirina însulînê be (Kucejova et al., 2016) ditepisîne, ku ev yek bi çavdêriyên ku mTORC1 bi navbeynkariya PPAR?-ê veguheztina Hmgcs2 asteng dike (Sengupta et al., 2010) re hevaheng e (2) Her weha Rêziknameya HMGCS1 û SCOT / OXCTXNUMX jî bibînin).

Çavdêriyên pêşîn ên ji koma me encamên neyînî yên kezebê yên kêmbûna ketogenîk pêşniyar dikin (Cotter et al., 2014). Ji bo ceribandina hîpoteza ku ketogenesis xerakirî, tewra di rewşên karbohîdartan-dagirtî û bi vî rengî "ne-ketogenîk" de, beşdarî metabolîzma anormal a glukozê dibe û steatohepatitis provoke dike, me modelek mişkî ya kêmasiya ketogenîk a diyarkirî bi rêvebirina oligonukleotîdên antîsens (AS) ji bo hedefan çêkir. Hmgcs2. Wendabûna HMGCS2 di mêşên mezinan ên bi xwarina kêm-rûn de bû sedema hîperglycemiya sivik û hilberîna bi sedan metabolîtên kezebê, ku komek ji wan bi tundî aktîvkirina lîpogenezê pêşniyar dike. Xwarina bi parêza rûn a mêşên bi ketojenezek ne bes bû sedema birîn û iltîhaba kezebê ya berfireh. Van dîtinan hîpotezên navendî piştgirî dikin ku (i) ketogenesis ne rêgezek derbasbûna pasîf e, lê di heman demê de girêkek dînamîkî ye di homeostaza fîzyolojîk a kezebê û yekbûyî de, û (ii) zêdekirina ketojenîkî ya biaqil ji bo sivikkirina NAFLD / NASH û metabolîzma glukozê ya kezebê ya têkçûyî hêjayî lêkolînê ye. .
Çawa dibe ku ketogenesiza xedar bibe sedema birîna kezebê û guheztina homeostaza glukozê? Nîqaşa yekem ev e ku gelo sûc kêmbûna herikîna ketogenîk e, an jî keton bixwe ye. Raporek vê dawîyê destnîşan dike ku laşên ketone dibe ku di bersiva n-3 asîdên rûn ên polyunsaturated de birîna kezebê ya ku ji stresa oksîtasyonê hatî çêkirin sivik bikin (Pawlak et al., 2015). Bînin bîra xwe ku ji ber nebûna îfadeya SCOT di hepatocîtan de, laşên ketone nayên oksîdan, lê ew dikarin beşdarî lîpojenezê bibin, û ji oksîtasyona wan cûda cûda rolên nîşangiran bikin (di heman demê de li çarenûsa metabolîzma ne-oksîdative ya laşên ketone û ?OHB jî binêre. navbeynkarek nîşangir). Di heman demê de mimkun e ku laşên ketonê yên ji hepatocîtan têne derxistin ji bo celebên hucreyên cîran ên di nav acinusa kezebê de, di nav de şaneyên stêrk û makrofajên hucreya Kupffer, wekî nîşanek û / an metabolîtek kar bikin. Digel ku wêjeya sînorkirî ya berdest destnîşan dike ku makrofage nikaribin laşên ketone oksîd bikin, ev tenê bi karanîna metodolojiyên klasîk ve hatî pîvandin, û tenê di makrofajên peritoneal de (Newsholme et al., 1986; Newsholme et al., 1987), destnîşan dike ku ji nû ve nirxandina guncan e ku di makrofajên ji mêjûya hestî de îfadeya SCOT-ê ya zêde tê dayîn (Youm et al., 2015).
Herikîna ketogenîk a hepatocît jî dibe ku sîtoprotektîv be. Digel ku mekanîzmayên xêrxwaz bi xwe ve girêdayî ketogenezê nebin, parêzên ketogenîk ên kêm karbohîdartan bi başkirina NAFLD re têkildar in (Browning et al., 2011; Foster et al., 2010; Kani et al., 2014; Schugar and Crawford, 2012) . Çavdêriyên me destnîşan dikin ku ketogeneza hepatocîtê dibe ku bertek nîşan bide û herikîna çerxa TCA, herikîna anaplerotîk, glukoneogenesisa ji fosphoenolpyruvate (Cotter et al., 2014), û tewra veguheztina glycogenê jî rêve bike. Kêmasiya ketojenîk rê dide acetyl-CoA ku herikîna TCA zêde bike, ku di kezebê de bi zêdebûna birîna ROS-a navbeynkar ve girêdayî ye (Satapati et al., 2015; Satapati et al., 2012); hêzên veguheztina karbonê di nav cureyên lîpîd ên de novo sentezkirî de ku dikarin sîtotoksîkî îspat bikin; û ji nû ve-oksîdkirina NADH-ê li NAD + asteng dike (Cotter et al., 2014) (Hêjî. 4). Bi hev re, ceribandinên paşerojê hewce ne ku mekanîzmayên ku bi navgîniya wan kêmasiya ketogenîk a têkildar dibe ku nebaş bibe, beşdarî hîperglycemiyê bibe, steatohepatitis provoke bike, û gelo ev mekanîzma di NAFLD / NASH-a mirovî de çalak in, hewce ne. Wekî ku delîlên epîdemîolojîkî di dema pêşkeftina steatohepatît de ketojenezê astengdar destnîşan dike (Embade et al., 2016; Marinou et al., 2011; Mânnist� et al., 2015; Pramfalk et al., 2015; Safaei, 2016 et.) dermankirinên ku ketogeneza kezebê zêde dikin dikarin serfiraz bibin (Degirolamo et al., 2016; Honda et al., 2016).
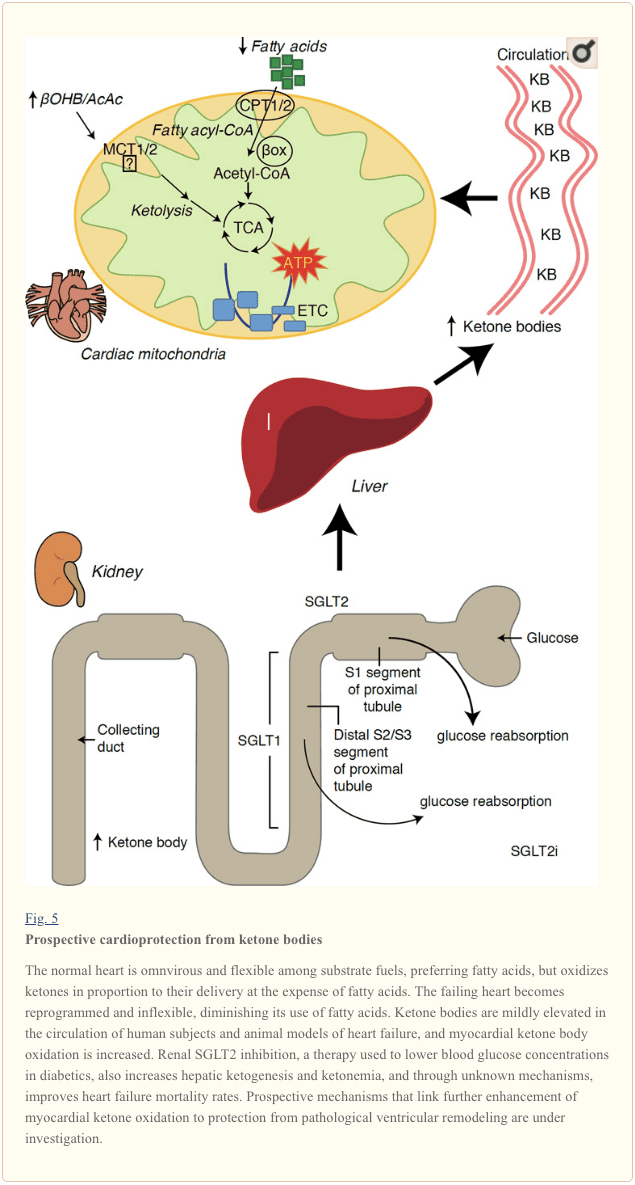
Desthilatên Keton û Xezeba Dilê (HF)
Digel rêjeya metabolê ya ku ji 400 kcal/kg/rojê derbas dibe, û veguheztina 6 kg ATP/roj, dil organa ku lêçûna enerjiyê ya herî zêde û daxwaziya oksîdatîf heye heye (Ashrafian et al., 35; Wang et al., 2007b). Piraniya mezin a veguhertina enerjiya myocardial di nav mitochondria de dimîne, û 2010% ji vê peydakirinê ji FAO-yê tê. Dil di bin şert û mercên normal de hemxwar û nerm e, lê dilê ku ji hêla patholojîkî ve ji nû ve hatî çêkirin (mînak, ji ber hîpertansiyon an înfarktê myokardial) û dilê diyabetîk her yek ji hêla metabolîk ve bêhêz dibe (Balasse and Fery, 70; BING, 1989; Fukao et al., 1954 ; Lopaschuk et al., 2004; Taegtmeyer et al., 2010; Taegtmeyer et al., 1980; Young et al., 2002). Bi rastî, anormaliyên bernamekirî yên genetîkî yên metabolîzma sotemeniya dil di modelên mişkî de cardiomyopathy provoke dikin (Carley et al., 2002; Neubauer, 2014). Di bin şert û mercên fîzyolojîkî de dilên normal li gorî radestkirina wan, li ser hesabê asîda rûnê û oksîdasyona glukozê, laşên ketone oksîjen dikin, û mîokard ji her yekîneya girseya laşê ketonê herî zêde xerîdar e (BING, 2007; Crawford et al., 1954; GARLAND et al. ., 2009; Hasselbaink et al., 1962; Jeffrey et al., 2003; Pelletier et al., 1995; Tardif et al., 2007; Yan et al., 2001). Li gorî oksîdasyona asîda rûnê, laşên ketone ji hêla enerjiyê ve bikêrtir in, ji bo senteza ATP-ê ji bo molekulek oksîjena veberhênandî (rêjeya P/O) bêtir enerjiyê peyda dikin (Kashiwaya et al., 2009; Sato et al., 2010; Veech, 1995) . Oksîdasyona laşê keton di heman demê de ji FAO-yê potansiyel enerjiyek bilindtir peyda dike, ubiquinone oxidized dihêle, ku di zincîra veguheztina elektronê de dirêjahiya redoksê zêde dike û ji bo senteza ATP-ê bêtir enerjiyê peyda dike (Sato et al., 2004; Veech, 1995). Oksîdasyona laşên ketone jî dibe ku hilberîna ROS-ê, û bi vî rengî stresa oksîdative jî kêm bike (Veech, 2004).
Lêkolînên pêşerojî û pêşniyarên destpêkê nîşan dide ku rola potansiyonê ya dilên ketone di dil de. Di encamên ischemia / rexnegirtina tengahiyê ya reperfusion de, ku bandorên xweseriya potatopotîk ên potansiyonê (El-Zaid et al., 2007; Wang et al., 2008), ji ber ku zêdebûna zêdebûna mitochondrial di dil û rêjîmê de ya fosphorylationê ya girîng Navdêr (Snorek et al., 2012; Zou et al., 2002). Di xebatên dawî de nîşan dide ku di laşên dilan ên mirinê de (Aubert et al., 2016) û mirovan (Bedi et al, 2016), pêşniyarên pêşî yên li mirovan li piştevanîya pêşniyarên (BING, 1954; Fukao et al. 2000; Janardhan et al., 2011; Longo et al., 2004; Rudolph û Schinz, 1973; Tildon û Kornblath, 1972). Di tevlêbûna laşên ketone de di pişka ramanan de, bi rasterast rêjeya zextan, çavdêranên ku mekanîzmaya û girîngiyê ne diyar e (Kupari et al, 1995; Lommi et al., 1996; Lommi et al., 1997; Neely et al. ., 1972), lê bi destûra bi kêmkirina SCOT-ê di pêşangeha cardiomyocytes de pîşesaziya vîdîkolojîk û rosksiyonên ROS-ê yên zordariyê yên zordestî yên zordarî (Schugar et al.
Çavdêriyên dawî yên dilxweş ên di di tedawiya diyabetesê de tedbîrên ku di metroolîzma myocardial ketone û remodeling pathologological (Nig 5) de tête dîtin. Nîşaneya nermalavê tîrêjê ya proximal-xenas-xNUMX (SGLT2i) -kulporter-golucose-a-germ di nav mirovan de (pişkîn û et al., 2a; Inagaki et al, 2016) û mice (Suzuki et al., 2015) zêde dibe hepatic ketogenesis (Ferrannini et al., 2014; Ferrannini et al., 2014a; Katz û Leiter, 2016; Mudaliar et al., 2015). Bi zehmetî, herî kêm yek ji van ajosteyên nexweşxaneya HF kêm kirin (mînak, wekî ku ji hêla ceribandina OUTCOME-ê ve tê vekirî ye), û mirinê kartiyofascular çêtirîn (Fitchett et al., 2015; Sonesson et al., 2016; Wu et al., 2016a ; Zinman et al., 2016). Dema ku rêbazên ajokrasî pişta HF encamên ku girêdayî girêdayî girêdayî SFLT2015i bi awayek nîqaşî berdewam dimîne, dibe ku dibe ku fînansê berxwedana pirrjimar, pir bi awayekî ket ketin, bi bandor, xwîna xwînê, asta glîkok û uric acid, pergalek nermî, pergala nermûsî, osmotic diuresis / kêmbûna plasma, û zêdebûna hematocrit (Raz û Cahn, 2; Vallon û Thomson, 2016). Bi hev vekişîn, têgihîştina ku di nexweşxaneyên HF'ê de an jî di HF nexweşan de zêde dibin an jî ew di metirsiyek bilind de, HF bi pêşveçûnê ye, lê di bin kontrola pêş-klînîk û klînîkal de di bin kontrola çalak de (Ferrannini et al., 2016b; Kolwicz et al. 2016; Lopaschuk û Verma, 2016; Mudaliar et al., 2016; Taegtmeyer, 2016).
Bodiesên Bîra Biyolojiya Ketone
Têkiliyên di navbera beden û kansera ketone de zû belav dibin, lê lêkolînên di modelên heywanan û mirovan de gelek encamên cuda hene. Ji ber ku metabolîzmê ketone dînamîk û nutriyê berpirsiyariya dewletê ye, ew e ku pêwendiyên biolojîk bi kansera biolojiyê re peyda dike, ji ber ku derfetên ji bo tedawiya nutûnî-rêberî veguherîn. Hucreyên kanser ji nûçegihandina metabolic veguhestin ji bo ku hilberîna hucreyên lezgîn ên bihêztir û biparêze (DeNicola û Cantley, 2015; Pavlova û Thompson, 2016). Pergala Warburgê ya di metabolîzma hucreyê kansera kanserê de ji rola serdestî û lactic acidê veguhertina enerjiyê veguherîne û ji bo feseriya jêrîn li fosphorylasyonê û laşê mîkroondûrî kêm (Dê Feyter et al, 2016; Grabacka et al. 2016; Kang et al., 2015; Poff et al., 2014; Şukla et al., 2014). Karbonê glucose bi sereke bi glycolysis, pentose rêwîtiya fosphate û rêberê lîpogenesisê ye, ku ji bo pêşveçûna tîmora biomassê (Grabacka et al., 2016; Şukla et al., 2014; Yoshii et al., 2015). Adaptasyona hucreyên kanseran ji bo kêmbûna nerazîbûna glucose ve dibe ku çavkaniyên alternatîfên alternatîf ên alternatîf, wek acetate, glutamine, û aspartate (Jaworski et al., 2016; Sullivan et al., 2015). Ji bo nimûne, gihîştina qedexekirina pyruvate ji bo hucreyên kanseran nîşan dide ku hewceyên glutamîn bi acetyl-CoA bi carboxylasyonê re, hemî hewceyên enerjî û anabolîk (Yang et al., 2014) biparêzin. Hişyariya balkêş a bendên kanser ên bikaranîna hucreyên acetate wek ebek (Comerford et al, 2014; Jaworski et al., 2016; Mashimo et al., 2014; Wright û Simone, 2016; Yoshii et al., 2015). Acetate jî ji bo lipogenesisê ye, ku ji bo tehlûkeya tûlorê ya tehlîm e, nerast e, û graviya vê lîpogenîk ve girêdayî ye ku bi bîhnfirehiya piçûktir û tîrêjê mezintir e (Comerford et al., 2014; Mashimo et al., 2014; Yoshii et al ., 2015).
Di dema kêmbûna glukozê de şaneyên ne-penceşêrê bi hêsanî çavkaniya enerjiya xwe ji glukozê vediguhezînin laşên ketone. Dibe ku ev plastîk di nav celebên hucreyên penceşêrê de guhezbartir be, lê di vivo de tîmorên mêjî yên pêçandî [2,4-13C2]-?OHB bi astek mîna tevna mêjî ya derdorê oksîde bûne (De Feyter et al., 2016). Modelên "bandora Warburgê ya berevajî" an "metabolîzma tumorê ya du beşan" hîpotez dikin ku hucreyên penceşêrê hilberîna ?OHB di fibroblastên cîran de çêdikin, hewcedariyên enerjiyê yên hucreya tumor peyda dikin (Bonuccelli et al., 2010; Martinez-Outschoorn et al., 2012) . Di kezebê de, veguheztinek di hepatocîtan de ji ketogenezê berbi oksîdasyona ketonê di hucreyên kansera hepatocellular (hepatoma) de bi aktîvkirina çalakiyên BDH1 û SCOT re ku di du xetên hucreyên hepatoma de têne dîtin re hevaheng e (Zhang et al., 1989). Bi rastî, hucreyên hepatoma OXCT1 û BDH1 îfade dikin û ketonan oksîd dikin, lê tenê dema ku serum birçî be (Huang et al., 2016). Wekî din, ketogeneza hucreya tumorê jî hatiye pêşniyar kirin. Guhertinên dînamîkî yên di vegotina gena ketogenîk de di dema veguheztina kanserê ya epîteliya kolonî de, celebek şaneyek ku bi gelemperî HMGCS2 îfade dike, têne xuyang kirin, û raporek vê dawîyê destnîşan kir ku HMGCS2 dibe ku nîşanek prognostîk a pêşbîniya nebaş a di kansera şaneya kolorektal û şaneyê de be (Camarero al. 2006; Chen et al., 2016). Ma ev komele hewce dike an ketogenesis, an fonksiyonek ronîkirina heyvê ya HMGCS2, pêdivî ye ku were destnîşankirin. Berevajî vê, hilberîna xuya ?OHB ji hêla hucreyên melanoma û glioblastoma ve, ku ji hêla PPAR? agonîst fenofibrate, bi girtina mezinbûnê re têkildar bû (Grabacka et al., 2016). Lêkolînên din hewce ne ku ji bo diyardekirina rola HMGCS2 / SCOT, ketogenesis, û oksîdasyona ketone di hucreyên kanserê de.
Ji derveyî warê metabolîzma sotemeniyê, keton di van demên dawî de bi mekanîzmayek nîşankirinê ve di biyolojiya hucreya penceşêrê de têne têkildar kirin. Analîza melanoma BRAF-V600E+ destnîşan kir ku bi OCT1-girêdayî vegirtina HMGCL bi rengek BRAF-girêdayî onkojenîk (Kang et al., 2015). Zêdekirina HMGCL bi giraniya AcAc a hucreyî ya bilind re têkildar bû, ku di encamê de pêwendiya BRAFV600E-MEK1 zêde kir, îşaretkirina MEK-ERK-ê di pêvekek pêş-rojanê de zêde dike ku berbelavbûn û mezinbûna hucreya tumorê dimeşîne. Van çavdêriyan pirsa balkêş a ketogeneza derveyî kezebê ya paşerojê derdixe holê ku wê hingê mekanîzmayek nîşankirinê piştgirî dike (di heman demê de bibînin ?OHB wekî navbeynkarek nîşangir û Nakokîyên di ketogeneza extrahepatîk de). Di heman demê de girîng e ku meriv bandorên serbixwe yên AcAc, d-?OHB, û l-?OHB li ser metabolîzma penceşêrê jî bihesibîne, û dema ku HMGCL tête hesibandin, dibe ku katabolîzma leucine jî xera bibe.
Bandorên parêzên ketogenîk (di heman demê de binihêrin Bikaranîna dermanî ya parêza ketogenîk û laşên keton ên biyanî) di modelên heywanên penceşêrê de cihêreng in (De Feyter et al., 2016; Klement et al., 2016; Meidenbauer et al., 2015; Poff et al., 2014; ., 2011; Seyfried et al., 2014; Shukla et al., 2016). Dema ku komeleyên epîdemîolojîk ên di nav qelewbûn, penceşêr û parêzên ketogenîk de têne nîqaş kirin (Liskiewicz et al., 2016; Wright and Simone, 2016), meta-analîzek ku parêzên ketogenîk di modelên heywanan de û di lêkolînên mirovan de bikar tîne bandorek xêrxwaz li ser zindîbûnê pêşniyar kir. feydeyên paşerojê bi mezinahiya ketosis, dema destpêkirina parêzê, û cîhê tumorê ve girêdayî ne (Klement et al., 2016; Woolf et al., 81). Dermankirina hucreyên penceşêrê yên pankreasê bi laşên ketone (d-?OHB an AcAc) mezinbûn, belavbûn û glycolîzê asteng dike, û parêzek ketogenîk (% 18 kcal rûn, 1% proteîn, 2014% karbohîdart) di vivo de giraniya tumor, glycemia, û di heywanên bi kansera pêçandî de masûlk û giraniya laş zêde kir (Shukla et al., 2014). Encamên bi vî rengî bi karanîna modelek hucreya glioblastoma ya metastatîk li mêşên ku di parêzê de lêzêdekirina ketone werdigirin hatin dîtin (Poff et al., 91). Berevajî vê, parêzek ketogenîk (9% rûn kcal, 2016% proteîn) giraniya ?OHB ya gerokê zêde kir û glycemia kêm kir, lê ti bandorek ne li ser qebareya tumor û ne jî li ser dirêjahiya zindîbûnê di mişkên glioma de nehişt (De Feyter et al., 2015). Endeksek ketone ya glukozê wekî nîşanek klînîkî hate pêşniyar kirin ku rêveberiya metabolê ya tedawiya kansera mêjî ya ku ji parêza ketogenîk ve hatî çêkirin di mirov û mişkan de çêtir dike (Meidenbauer et al., XNUMX). Bi hev re, rolên metabolîzma laşê ketone û laşên ketone di biyolojiya penceşêrê de dilşikestî ne ji ber ku ew her yek vebijarkên dermankirinê yên domdar vedigirin, lê hêmanên bingehîn têne ronî kirin, digel ku bandorên zelal ên ji matrixek guherbaran derdikevin, di nav de (i) cûdahiyên di navbera ketoneya exogenous de. laş li hember parêza ketogenîk, (ii) celebê şaneya penceşêrê, polîmorfîzma genomîk, derec û qonax; û (iii) dem û dirêjahiya rûdana rewşa ketotîk.

Ketogenesis ji alozên ketone ve ji ber hilweşandina fîştiyên fatiyayî û ketin amino-ketogenic ve hatiye afirandin. Ev pêvajoya biyohemîk bi enerjiyê bi gelek organan re, bi taybetî bi mêjû, di bin şertên rojane de wek bersivdayîna nehebbûna xwîna glucose. Cesyonên Ketone bi taybetî li mitokondria ya hucreyên liverê têne hilberandin. Dema ku hucreyên din dikarin bi kozogenesisê derxînin, ew ne bi awayekî bandor li ser hucreyên zindî ne. Ji ber ku ketogenesis di mitochondria de pêk tê, pêvajoyên wê serbixwe têne rêve kirin. Dr. Alex Jimenez DC, CCST Insight
Serîderên Tipê yên Ketogenic Diet û Axên Exogenous Ketone
Serîlêdanên parêzên ketogenîk û laşên ketone wekî amûrên dermankirinê jî di çarçoveyên ne-penceşêrê de, di nav de qelewbûn û NAFLD/NASH (Browning et al., 2011; Foster et al., 2010; Schugar and Crawford, 2012); têkçûna dil (Huynh, 2016; Kolwicz et al., 2016; Taegtmeyer, 2016); Nexweşiya neurolojîk û neurodejenerative (Martin et al., 2016; McNally and Hartman, 2012; Rho, 2015; Rogawski et al., 2016; Yang and Cheng, 2010; Yao et al., 2011); xeletiyên xwerû yên metabolîzmê (Scholl-B�rgi et al, 2015); û performansa werzîşê (Cox et al., 2016). Bandora parêzên ketogenîk bi taybetî di tedawiya girtina epîleptîk de, nemaze di nexweşên berxwedêr ên derman de, hate pesend kirin. Pir lêkolînan di nexweşên pediatrîkî de parêzên ketogenîk nirxandiye, û piştî 50 mehan kêmbûnek ~ 3% di frekansa girtinê de, bi baştirkirina bandorkeriya di sindromên bijartî de diyar dike (Wu et al., 2016b). Ezmûn di serpêhatiya mezinan de tixûbdartir e, lê kêmbûnek wusa diyar e, bi bersivek çêtir di nexweşên serpêhatiya giştîkirî ya nîşankirî de (Nei et al., 2014). Di bin mekanîzmayên antî-konvulsant de ne diyar in, her çend hîpotezên hatine destnîşan kirin kêmbûna karanîna glukozê / glycolîzê, veguheztina glutamate ji nû ve bernamekirî, bandora neyekser li ser kanala potasyum-hesas a ATP an receptorê adenosine A1, guheztina îfadeya isoformê ya kanala sodyûmê, an bandorên li ser hormonên gerîdok, di nav de Lambrechts et al., 2016; Lin et al., 2017; Lutas and Yellen, 2013). Ne diyar e ka gelo bandora dij-konvulsantan bi bingehîn ji laşên ketone ve girêdayî ye, an ji ber encamên metabolîk ên kaskî yên parêzên kêm karbohîdartan e. Digel vê yekê, esterên ketone (li jêr binêre) xuya dike ku di modelên heywanan ên destgirtinên provokatîf de bendavêjê bilind dikin (Ciarlone et al., 2016; D'Agostino et al., 2013; Viggiano et al., 2015).
Atkins-style û ketogenic, pir caran xweyên carbohydrate kêm têne derxistin, û dibe sedema birçîbûnê, hyperuricemia, duralcemia, hîpomagnesemiya, rêberê nephrolîtiyyîyan, ketoacidosos, sedemên hîplerglycemia, û razînolê û felîdê fatty-êleyên acil ên xweser (Bisschop et al. 2001 ; Kossoff û Hartman, 2012; Kwiterovich et al., 2003; Suzuki et al., 2002). Ji ber van sedemên, pêkanîna demdirêj a demokrasiyê pêk tê. Lêkolînên zehf bi gelemperî belavkirina macronutrient taybet (94% kcal fat, 1% kcal carbohydrate, 5%% kcal protein, Bio-Serv F3666), ku bi hêzek ketosînek xurt dike. Lêbelê, naveroka proteîneyê zêde dibe, heta ku ji 10% kcal bi gelemperî kêm kete kêmasiyê, û 5%% kcal qedexekirina protein veguherîne bandorên metabolic û fîzîkîolojî. Di vê formê de xwarinê de xwarina xwarinê jî çolê xeletî ye, ku celebek din ku bandor li ser zehmetiya zehfê, û heta ku ketogenesis (Garbow et al., 2011; Jornayvaz et al. 2010; Kennedy et al., 2007; Pissios et al., 2013; Schugar et al., 2013). Heke bandorên dirêjkirina xweya dirêj ên ketogenic di çarçoveyê de di çarçoveyê de tête diyarkirin, lê lêkolînên paşîn ên nû di bendê normal de berbiçav û nebûna neheqiyên zehfê yên liverê ketogenic dihezên xwe li ser seranserê xwe de, tevî ku amino acid, lêçûnên amînê, têne şaş kirin (Douris et al., 2015).
Mîkroozîsyonên bi rêbazên kîtos zêde dibin alternatîfên ketogenic di nav deverên laş ên kevnê de tê bikaranîn. Rêveberiya xweserên bêogenous ketone dikare dikare dewletek fîzîkî ya ku ne di fîzîkolojiya normal de pêk hat, çêbikin, ji ber ku guluco û însulîn tevlihev dibe normal, lê dibe ku hucreyan dikarin gûlekek gûlekêşî û bikar tînin. Laşên ketonî bi xwe xwedan nîv-jiyana kurt in, û vexwarin an înfuzyona xwêya sodyûm ?OHB ji bo bidestxistina ketoza dermanker barek sodyûmê ya nebaş provoke dike. R/S-1,3-butanediol dîalkolek ne-jehrîn e ku bi hêsanî di kezebê de oksîde dibe ku d/l-?OHB peyda bike (Desrochers et al., 1992). Di şert û mercên ceribandinê yên cihêreng de, ev doz bi qasî heft hefteyan rojane ji mişk an mişkan re tê dayîn, di nav 5 saetan de ji danasînê de ?OHB-ya ?OHB-ê di nav 2 mM-ê de, ku bi kêmanî 3 demjimêrên din domdar e (D' Agostino et al., 2013). Zordariya partiya xwarinê ya R / S-1,3-butanediol (Carpenter û Grossman, 1983) da ku li rodents hatine dîtin. Wekî din, sê esterên ketone yên kîmyewî yên cuda (KEs), (i) monoestera R-1,3-butanediol û d-?OHB (R-3-hydroxybutyl R-?OHB); (ii) glyceryl-tris-?OHB; û (iii) R,S-1,3-butanediol acetoacetate diester, di heman demê de bi berfirehî hatine lêkolîn kirin (Brunengraber, 1997; Clarke et al., 2012a; Clarke et al., 2012b; Desrochers et al., 1995a; ., 1995b; Kashiwaya et al., 2010). Avantajek xwerû ya ya berê ev e ku 2 mol d-?OHB fîzyolojîkî ji her molek KE re, li dû hîdrolîza esterase di rûvî an kezebê de têne hilberandin. Ewlehî, pharmacokinetics, û tolerans bi berfirehî li ser mirovên ku R-3-hydroxybutyl R-?OHB, bi dozên heya 714 mg/kg vedixwin, bi d-?OHB-ê di gerokê de heya 6 mM vedixwe, hatine lêkolîn kirin (Clarke et al., 2012a; Cox et al., 2016; Kemper et al., 2015; Shivva et al., 2016). Di rodentan de, KE ev kE, koleksiyonê kalorîk û kolîzma kolekololê kêm dike, tisûya adipose bîr tehlîm dike, û berxwedana însulîn (Kashiwaya et al., 2010; Kemper et al., 2015; Axaftina, 2013). Encamên dawî destnîşan dikin ku di dema werzîşê de di werzîşvanên perwerdekirî de, vexwarina R-3-hydroxybutyl R-?OHB glycolyza masûlkeya skeletal û giraniya laktate ya plazmayê kêm kir, oksîdasyona triacylglycerol a navmuskuler zêde kir, û naveroka glycogenê ya masûlkeyê parast, tewra dema ku bi hev re karbohîdartan derxistina însulînê teşwîq dike. Cox et al., 2016). Di pêşveçûnê de encamên van xemgîn ên pêwîst e, ji ber ku pêşveçûnê di xebitandina performansê de xebatkariya xebitandinê bi piranî bi bersiva xurt a KE di mijarên 2 / 8 ve têne kirin. Lêbelê, encama van encamên piştgiriya xebatên klasîk ên piştgirî dikin ku ji bo pêşniyara ketone oxonasyonên din ên li substrates (GARLAND et al, 1962; Hasselbaink et al., 2003; Stanley et al., 2003; Valente-Silva et al, 2015), Di nav dema karanînê de, û ku hewlên perwerde dibe bêtir sereke bi karbidestan (Johnson et al., 1969a; Johnson û Walton, 1972; Winder et al., 1974; Winder et al., 1975). Di dawiyê de, mekanîzmayên ku dibe ku piştgiriya karûbarên çêtirîn bi piştgiriya calorîk (parvekirî ve di nav macronutriyan de belav kirin) û hevpeymanên xweya xweser ên wekhev bimîne.
Perspective Future
Gava ku bi giranî wekî rêgezek zêde hatî stigmatîze kirin ku karibe emeliyetên jehrîn ên ji şewitandina rûnê di rewşên sînorkirî yên karbohîdartan de berhev bike (paradîgmaya "ketotoxic"), çavdêriyên vê dawîyê piştgirî didin vê têgînê ku metabolîzma laşê ketone di rewşên dagirtî yên karbohîdartan de jî rolek xêrxwazî dike, û vekirina "ketohormetîk". � hîpotez. Digel ku nêzîkatiyên xwarin û dermankolojîk ên hêsan ên ji bo manîpulekirina metabolîzma ketone wê dikin armancek dermankirinê ya balkêş, bi tundî têne xêz kirin lê ceribandinên hişyar hem di laboratuarên lêkolîna bingehîn û hem jî yên werger de dimînin. Pêdiviyên bêserûber di warên diyarkirina rola bikêrhatina metabolîzma ketonê de di têkçûna dil, qelewbûn, NAFLD / NASH, şekirê şekir 2, û penceşêrê de derketine. Qad û bandora rolên îşaretkirina 'ne-kanonîkî' yên laşên ketone, di nav de rêziknameya PTM-ên ku îhtîmal e ku paş û pêş ve di rêyên metabolîk û îşaretkirinê de vedigerin, lêkolînek kûrtir hewce dike. Di dawiyê de, ketogeneza extrahepatîk dikare mekanîzmayên nîşankirina parakrîn û otokrîn û fersendên balkêş veke ku bandorê li hev-metabolîzma di nav pergala nervê û tumoran de bike da ku bigihîje armancên dermankirinê.
Spasî
Ncbi.nlm.nih.gov/pmc/articles/PMC5313038/
Footnotes
Di encamê de, laşên ketone ji hêla kezebê ve têne afirandin da ku wekî çavkaniyek enerjiyê were bikar anîn dema ku di laşê mirovan de têra glukozê tune be. Ketogenesis dema ku di xwînê de asta glukozê ya kêm hebe, bi taybetî piştî ku depoyên karbohîdratên din ên hucreyî qediyane pêk tê. Armanca gotara li jor nîqaşkirina rolên pir-alî yên laşên ketone di metabolîzma sotemeniyê, nîşankirin û dermankirinê de bû. Qada agahdariya me bi pirsgirêkên tenduristiya chiropractîk û spinal ve sînorkirî ye. Ji bo nîqaşkirina mijarê, ji kerema xwe ji Dr. Jimenez bipirsin an bi me re têkilî daynin915-850-0900.
Dr. Alex Jimenez
Ji: Ncbi.nlm.nih.gov/pmc/articles/PMC5313038/

Nîqaşa Mijara Zêde:. Paina Paşê ya Akut
Êşa piştêEw li seranserê cîhanê li seranserê cîhanê sedemên seqetî û rojên bêriya xebatê ye. Painşa piştê sedema duyemîn a herî hevpar a serdanên ofîsa doktor dide, tenê ji hêla enfeksiyonên nefesê yên jorîn zêdetir e. Nêzîkî ji sedî 80yê nifûsê di jiyana xwe de herî kêm carekê êşa piştê dikişîne. Spine avahiyek tevlihev e ku ji hestî, lebat, lebat û masûlke, di nav lebatên nerm ên din de pêk tê. Birîndar û / an mercên giran, wek dîsên herniated, di dawiyê de dikare bibe sedema nîşanên êşa piştê. Birîndariyên werzîşê an birînên qezaya otomobîlan bi gelemperî sedemên herî êşên piştê ne, lêbelê, carinan tevgerên herî hêsan dikarin encamên êşdar çêbikin. Bi kêfxweşî, vebijarkên dermankirinê yên alternatîf, wekî lênihêrîna chiropractic, dikare bi karanîna verastkirinên stûn û manîpulasyonên destan re êşa piştê sivik bike, di dawiyê de başkirina êş.

EXTRA EXTRA | BİXWÎNE BİXWÎNE: Pêşwazî El Paso, TX Chiropractor
***
Agahdariya li ser "Rolesên Pir-Dimensional yên Ketone" ne armanc e ku têkiliyek yek-bi-yek bi pisporek lênihêrîna tenduristî ya jêhatî an bijîjkek destûrdar re biguhezîne û ne şîreta bijîjkî ye. Em we teşwîq dikin ku hûn li gorî lêkolîn û hevkariya xwe bi pisporek lênihêrîna tenduristî ya jêhatî re biryarên lênihêrîna tenduristiyê bidin.
Agahdariya Blog & Nîqaşên Berfireh
Qada agahdariya me bi Chiropractic, musculoskeletal, dermanên laşî, tenduristî, beşdariya etiolojîk ve sînorkirî ye nexweşiyên viscerosomatîk di nav pêşandanên klînîkî de, dînamîkên klînîkî yên refleksa somatovisceral ên têkildar, kompleksên subluksasyonê, pirsgirêkên tenduristiyê yên hesas, û / an gotar, mijar û nîqaşên dermanê fonksiyonel.
Em pêşkêş dikin û pêşkêş dikin hevkariya klînîkî bi pisporên ji dîsîplînên cuda. Her pispor ji hêla qada pratîkê ya pîşeyî û dadrêsiya lîsansê ve tê rêve kirin. Em protokolên tenduristî û başbûnê yên fonksiyonel bikar tînin da ku ji bo birîn an nexweşiyên pergala masûlkeyê derman bikin û piştgirî bikin.
Vîdyo, post, mijar, mijar û têgihiştinên me mijarên klînîkî, pirsgirêk û mijarên ku têkildar in û rasterast an nerasterast piştgirî didin qada pratîka meya klînîkî vedigirin.*
Ofîsa me bi awayekî maqûl hewl daye ku navgînên piştgirî peyda bike û lêkolîna lêkolînê an lêkolînên têkildar ên ku postên me piştgirî dikin nas kiriye. Em li ser daxwazê kopiyên lêkolînên piştevaniya lêkolînan ji bo desteyên nîzam û raya giştî peyda dikin.
Em fêhm dikin ku em mijarên ku vegotinek din hewce dike vedihewîne ka ew çawa dikare di nexşeya lênihînê an protokola dermankirinê ya taybetî de bibe alîkar; ji ber vê yekê, ji bo ku em li jor mijara li jor nîqaş bikin, ji kerema xwe bipirsin Dr. Alex Jimenez, DC, An bi me re têkilî bikin 915-850-0900.
Em li vir in ku alîkariya we û malbata we bikin.
Pîroziya
Dr. Alex Jimenez D.C., MSACP, RN*, CCST, IFMCP*, CIFM*, atn*
email: coach@elpasofunctionalmedicine.com
Di nav de wekî Doktorê Chiropractic (DC) destûrdayî ye texas & New Mexico*
Lîsanseya Texas DC # TX5807, New Mexico DC License # NM-DC2182
Wekî hemşîreyek Qeydkirî (RN*) destûrdar e in florida
Florida License RN License de # RN9617241 (Kontrol No. 3558029)
Rewşa kompakt: License de pir-dewletê: Desthilatdar e ku di pratîkê de Dewletên 40*
Alex Jimenez DC, MSACP, RN* CIFM*, IFMCP*, ATN*, CCST Dr.
Karta Karsaziya Min a Dîjîtal